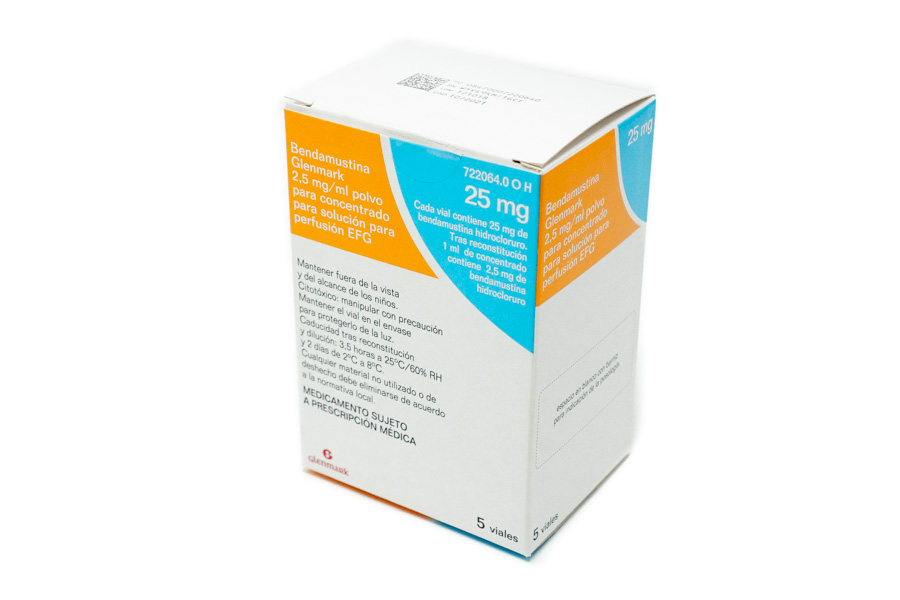
Código Nacional
7220640
Nombre del medicamento
BENDAMUSTINA GLENMARK EFG
Forma farmacéutica
INYECTABLE INTRAVENOSO
Laboratorio
Estado de autorización
AUTORIZADO
Grupo Terapéutico ATC Nivel 3:
AGENTES ALQUILANTES
Grupo Terapéutico ATC Nivel 4:
ANALOGOS DE LA MOSTAZA NITROGENADA
Composición de: BENDAMUSTINA GLENMARK EFG
Principio activo:
Cada INYECTABLE INTRAVENOSO contiene:
25 MILIGRAMOS de BENDAMUSTINA CLORHIDRATO
Estado de autorización: AUTORIZADO
Estado de comercialización: Comercializado
Fecha autorización: 06/05/2019
Fecha comercialización: 09/10/2019
Receta médica: (R) RECETA MEDICA
Caducidad inferior a 5 años
Proteger de la luz
Siga exactamente las instrucciones de administración de BENDAMUSTINA GLENMARK EFG indicadas por su médico o farmacéutico. En caso de duda, consulte de nuevo a su médico o farmacéutico.
Perfusión intravenosa durante 30 a 60 min. En el caso de pacientes con mieloma múltiple se puede administrar tanto en perfusión iv como por vía oral.
Al igual que todos los medicamentos, BENDAMUSTINA GLENMARK EFG puede modificar o ver modificado su efecto como consecuencia de otras sustancias, incluyendo otros medicamentos, alimentos, tabaco o alcohol.
Informe a su médico o farmacéutico si está utilizando o ha utilizado recientemente otros medicamentos, incluso los adquiridos sin receta médica, homeopáticos, plantas medicinales y otros productos relacionados con la salud, ya que puede ser necesario interrumpir el tratamiento o ajustar la dosis de alguno de ellos.
Al igual que todos los medicamentos, BENDAMUSTINA GLENMARK EFG puede producir efectos adversos, aunque no todas las personas los sufran.
Si experimenta cualquier tipo de efecto adverso, consulte a su médico, farmacéutico o enfermero, incluso si se trata de posibles efectos adversos que no apareciesen en el prospecto que acompaña a su medicamento. También puede comunicarlos directamente a través del Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano, en la página web www.notificaram.es
Si toma más BENDAMUSTINA GLENMARK EFG del que debe, consulte inmediatamente a su médico o farmacéutico, vaya al servicio de urgencias de su hospital más cercano o llame al Servicio de Información Toxicológica, teléfono: 91 562 04 20, indicando el medicamento y la cantidad ingerida.
Si acude al médico o farmacéutico es recomendable llevar siempre con usted el medicamento o su prospecto.
No utilice este medicamento después de la fecha de caducidad que aparece en el envase después de CAD. La fecha de caducidad es el último día del mes que se indica.
Los medicamentos no se deben tirar por los desagües ni a la basura. Deposite los envases y los medicamentos que no necesita en el Punto SIGRE de la farmacia. En caso de duda pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que no necesita. De esta forma ayudará a proteger el medio ambiente.
BENDAMUSTINA GLENMARK EFG en el EMBARAZO: usar sólo bajo recomendación del médico


