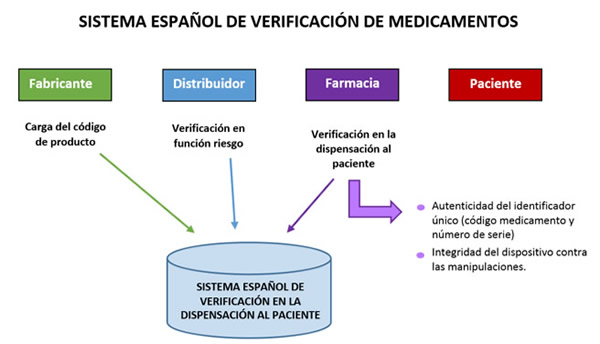
El Reglamento Delegado 2016/161 establece un sistema en que la identificación y autenticación de los medicamentos están garantizadas por una verificación de extremo a extremo de todos los medicamentos que llevan dispositivos de seguridad, completada con la verificación por los mayoristas de determinados medicamentos con mayor riesgo de falsificación.
En la práctica, la autenticidad y la integridad de los dispositivos de seguridad colocados en el envase de un medicamento al comienzo de la cadena de suministro deben verificarse cuando se dispense el medicamento al público, si bien pueden aplicarse algunas excepciones.
No obstante, los medicamentos con mayor riesgo de falsificación deben ser además verificados por los mayoristas en toda la cadena de suministro, para minimizar el riesgo de que los medicamentos falsificados que circulen pasen desapercibidos durante mucho tiempo.
La autenticidad de un identificador único debe verificarse comparándolo con el identificador único genuino almacenado en un sistema de repositorios. Si el envase se suministra al público, se distribuye fuera de la Unión, o en otras situaciones específicas, el identificador único de ese envase se desactivará en el sistema de repositorios, de manera que cualquier otro envase que lleve el mismo identificador único no pueda verificarse.
Debe poderse identificar y verificar la autenticidad de cada envase de un medicamento durante todo el tiempo que se mantenga en el mercado, más el tiempo adicional necesario para la devolución y la eliminación del envase tras su caducidad.
Por ello, la secuencia de caracteres resultante de la combinación del código de producto y del número de serie debe ser exclusiva para cada envase de un medicamento hasta, al menos, un año después de su fecha de caducidad o hasta cinco años después de que el medicamento haya sido puesto a la venta o distribuido (si este plazo fuera mayor).
A fin de facilitar a los mayoristas y a las personas autorizadas o facultadas para dispensar medicamentos la verificación de la autenticidad y la desactivación de un identificador único, es preciso garantizar que la estructura y la calidad de impresión del código de barras bidimensional que lo contiene permitan su lectura de alta velocidad y minimizar errores de lectura.
Los elementos de datos del identificador único irán impresos en el envase en formato legible por las personas, para que pueda verificarse la autenticidad del identificador único y desactivarse este en caso de que el código de barras bidimensional sea ilegible.
Para disponer de un sistema de verificación de extremo a extremo se tiene que crear un sistema de repositorios en el que se conserve, entre otras cosas, la información sobre los identificadores únicos genuinos de un medicamento y que pueda consultarse para verificar la autenticidad de un identificador único y desactivarlo.
Este sistema de repositorios deben crearlo y gestionarlo los titulares de la autorización de comercialización, pues son los responsables de la comercialización del medicamento, y los fabricantes de los medicamentos que lleven dispositivos de seguridad, pues los costes del sistema de repositorios corren a su cargo
La base de datos donde se almacenan los identificadores únicos de los medicamentos debe contener las interfaces necesarias para el acceso de mayoristas y personas autorizadas o facultadas para dispensar medicamentos y las autoridades nacionales competentes para el cumplimiento de las obligaciones establecidas en el Reglamento Delegado.
Deberán ser verificados los medicamentos con receta (excepto los radiofármacos y los incluidos en el anexo 1 del Reglamento) y los medicamentos sin receta considerados en riesgo de ser falsificados.
El Sistema de Verificación implica, por tanto, a todos los agentes de la cadena de suministro de medicamentos: