Antihistamínicos sedantes de primera generación en formulaciones orales líquidas: contraindicado su uso en Australia en niños menores de 2 años
 Nº415
Nº415
La agencia australiana de medicamentos, Therapeutic Goods Administration (TGA), ha informado de las medidas estrictas para evitar el uso en niños menores de 2 años de los antihistamínicos de primera generación (p.ej., prometazina). El motivo han sido los casos mortales por depresión respiratoria en niños menores de 2 años, debido al riesgo potencial de depresión respiratoria, que puede ser mortal.
La agencia de medicamentos de Australia, Therapeutics Goods Agency (TGA) ha informado1 de los casos mortales por depresión respiratoria en niños menores de 2 años.
La TGA junto con los laboratorios titulares de los medicamentos correspondientes ha planeado elaborar medidas para fortalecer las advertencias en la información del producto (PI, o ficha técnica) y la información para el consumidor (CMI, o prospecto) para los medicamentos orales con antihistamínicos de primera generación, para enfatizar que no deberían ser utilizados en niños menores de dos años, debido al riesgo potencial de depresión respiratoria grave. Además, la TGA propondrá incluir una advertencia obligatoria en el etiquetado de estos medicamentos, que no necesitan receta médica (son OTC, over-the-counter) en formulaciones líquidas orales con antihistamínicos sedantes, conocidos como de primera generación, sobre la contraindicación de uso en niños menores de dos años.
Recientemente, la TGA ha revisado un caso mortal de depresión respiratoria en un bebé de 74 días, que fue tratado con un medicamento OTC líquido oral con prometazina. Aunque la muerte del bebé no se llegó a atribuir al uso de la prometazina, se constató una gran preocupación sobre su seguridad.
Se revisaron los casos reunidos en la base de datos de la TGA de notificaciones de sospechas de reacciones adversas (RAM). Hasta el 15 de noviembre de 2017, se identificaron 45 notificaciones de sospechas de RAM en niños menores de dos años, en los que se describe como único fármaco sospechoso a un medicamento antihistamínico sedante oral de primera generación. Estas notificaciones constatan una gama de efectos adversos, incluyendo reacciones de hipersensibilidad, agitación, movimientos anormales, vómitos y diarrea.
Recomendaciones
La TGA reforzará las advertencias para contraindicar el uso en niños menores de 2 años de los medicamentos OTC con antihistamínicos sedantes orales de primera generación El riesgo de depresión respiratoria en bebés también se aplica a otros antihistamínicos OTC sedantes orales de primera generación como: prometazina, bromfeniramina, clorfeniramina, dexclorfeniramina, difenhidramina, doxilamina, feniramina, alimemazina (trimeprazina), triprolidina.
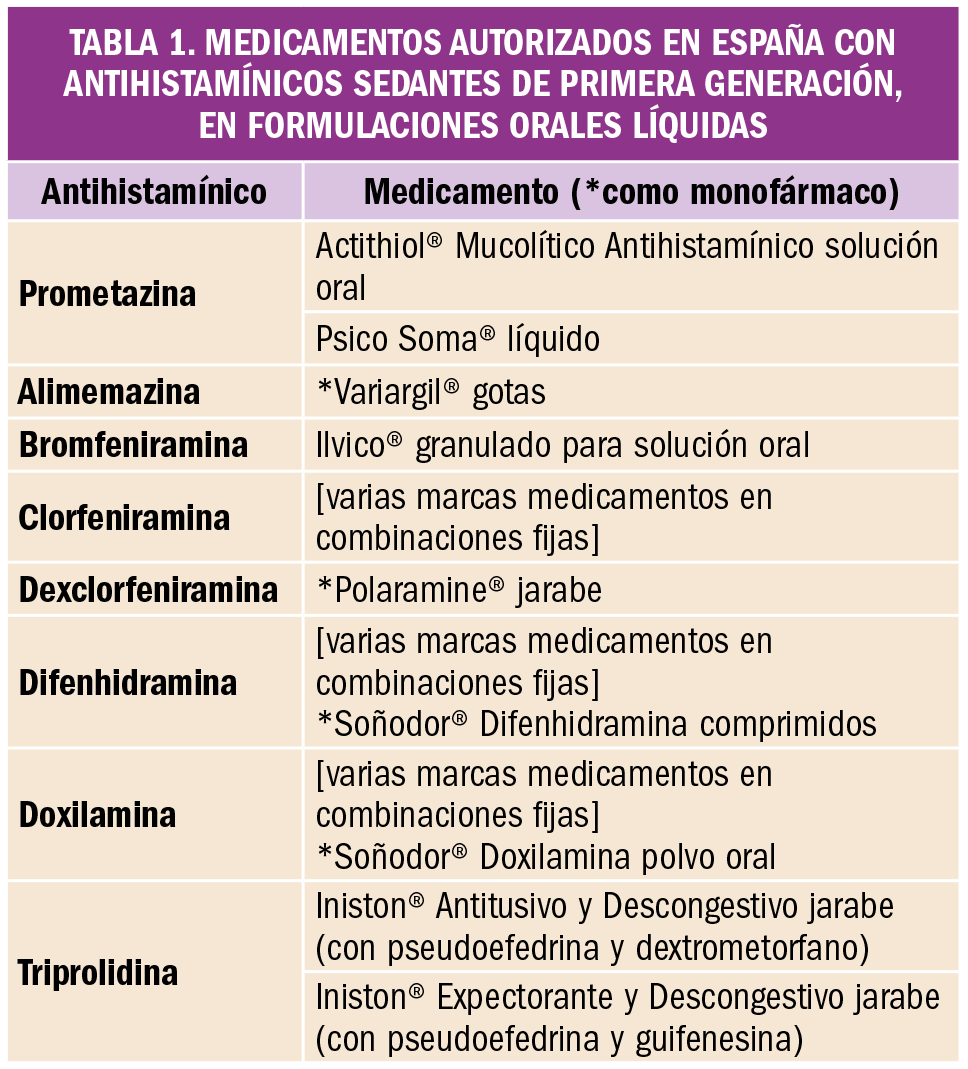
Los medicamentos con antihistamínicos orales líquidos de primera generación que existen en España están contraindicados en niños menores de 2 años. En la Tabla 1 se describen algunos de los medicamentos disponibles, en formulaciones liquidas con estos antihistamínicos.
Referencias
- Therapeutic Goods Administration. First-generation oral sedating antihistamines – use in children. Medicines Safety Update 2018; 9 (1): 1-2. Disponible en la web: https://www.tga.gov.au/sites/default/files/medicines-safety-update-volume-_9-number-1-february-march-2018.pdf (consultado 3 julio 2018).
IMPORTANTEEl Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano (SEFV-H) se basa en el programa de notificación espontánea de un profesional sanitario (médico, odontólogo, farmacéutico, enfermero, otros) de una sospecha de relación entre un medicamento (incluidos vacunas, sueros, gases medicinales, fórmulas magistrales, plantas medicinales) y un síntoma o signo adverso (reacción adversa, RAM) que manifieste el paciente (programa de tarjeta amarilla). El Real Decreto 577/2013 de Farmacovigilancia de medicamentos de uso humano (BOE núm. 179, de 27 de julio de 2013) entró en vigor el 28 de julio de 2013. La Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) coordina el SEFV-H. A su vez se integra en el Sistema Europeo de Farmacovigilancia que desde 1995 coordina la Agencia Europea de Medicamentos (EMA), y participa desde 1984 en el Programa Internacional de Farmacovigilancia de la OMS, junto con más de 130 países. |
| ¿DÓNDE CONSULTAR LAS FICHAS TÉCNICAS Y PROSPECTOS DE LOS MEDICAMENTOS? En la página web de la AEMPS http://www.aemps.gob.es >> seleccionando >> ”CIMA: Centro de Información on-line de Medicamentos de la AEMPS, Humanos”, se pueden consultar por nombre comercial o por sus principios activos. También están disponibles en la base de datos BOT Plus. NOTA: la mención de marcas comerciales en el texto solo tiene fines de identificación, y en absoluto se les debe asignar directamente lo descrito en el texto. |
Artículos relacionados
-
6 Ago 2024Warfarina y riesgo de hemorragias por interacción farmacológica con tramadol: recordatorio en Reino Unido Farmacovigilancia
-
6 Ago 2024La AEMPS informa del riesgo de neoplasias malignas secundarias de células T asociado a terapias CAR-T Farmacovigilancia
-
6 Ago 2024Uso de metamizol y riesgo de agranulocitosis: se inicia en Europa su evaluación global Farmacovigilancia




