Información de seguridad procedente de la evaluación periódica de los datos de farmacovigilancia que decide el Comité Europeo para la Evaluación de Riesgos en Farmacovigilancia (PRAC)
 Nº428
Nº428
El Comité Europeo para la Evaluación de Riesgos en Farmacovigilancia (PRAC) ha acordado cambios en la información autorizada de las fichas técnicas y de los prospectos de los medicamentos europeos por motivos de seguridad. Una vez que se revisan y evalúan los datos de los informes periódicos de seguridad (IPS; en inglés, PSUR), de forma colaborativa entre todas las 27 agencias nacionales, se presentan los cambios y se acuerdan en las reuniones mensuales del PRAC. A continuación, se muestran los últimos cambios de información de seguridad acordados recientemente en el PRAC.
El Comité europeo para la Evaluación de Riesgos en Farmacovigilancia (PRAC) ha acordado cambios en las fichas técnicas y los prospectos de los siguientes medicamentos, siendo los más importantes los descritos a continuación (Tabla 2), según informa la AEMPS en su Boletín Mensual de julio de 20194. Las fichas técnicas y prospectos de los medicamentos pueden consultarse en la web de la AEMPS, dentro de la sección CIMA: Centro de Información Online de Medicamentos.
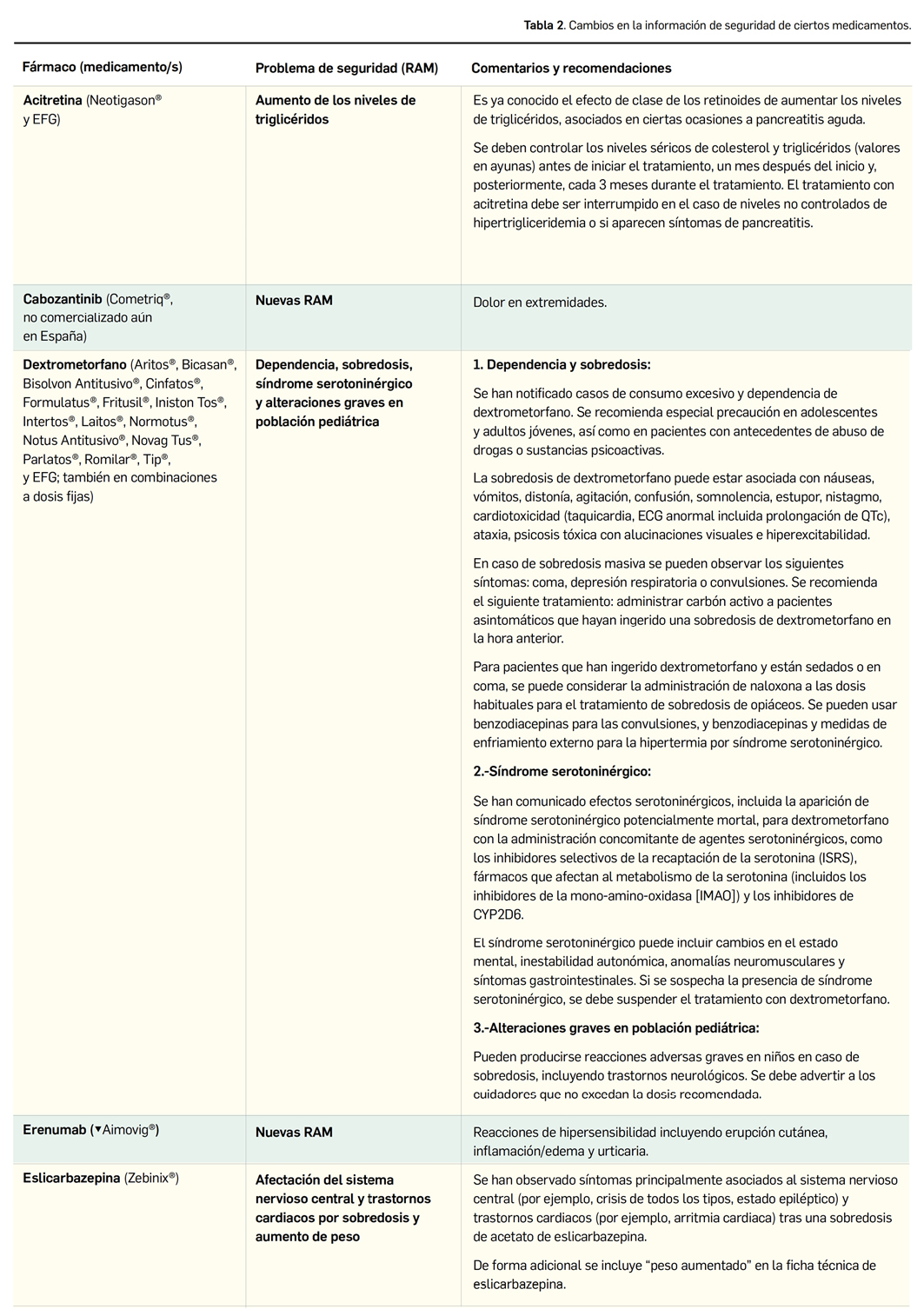
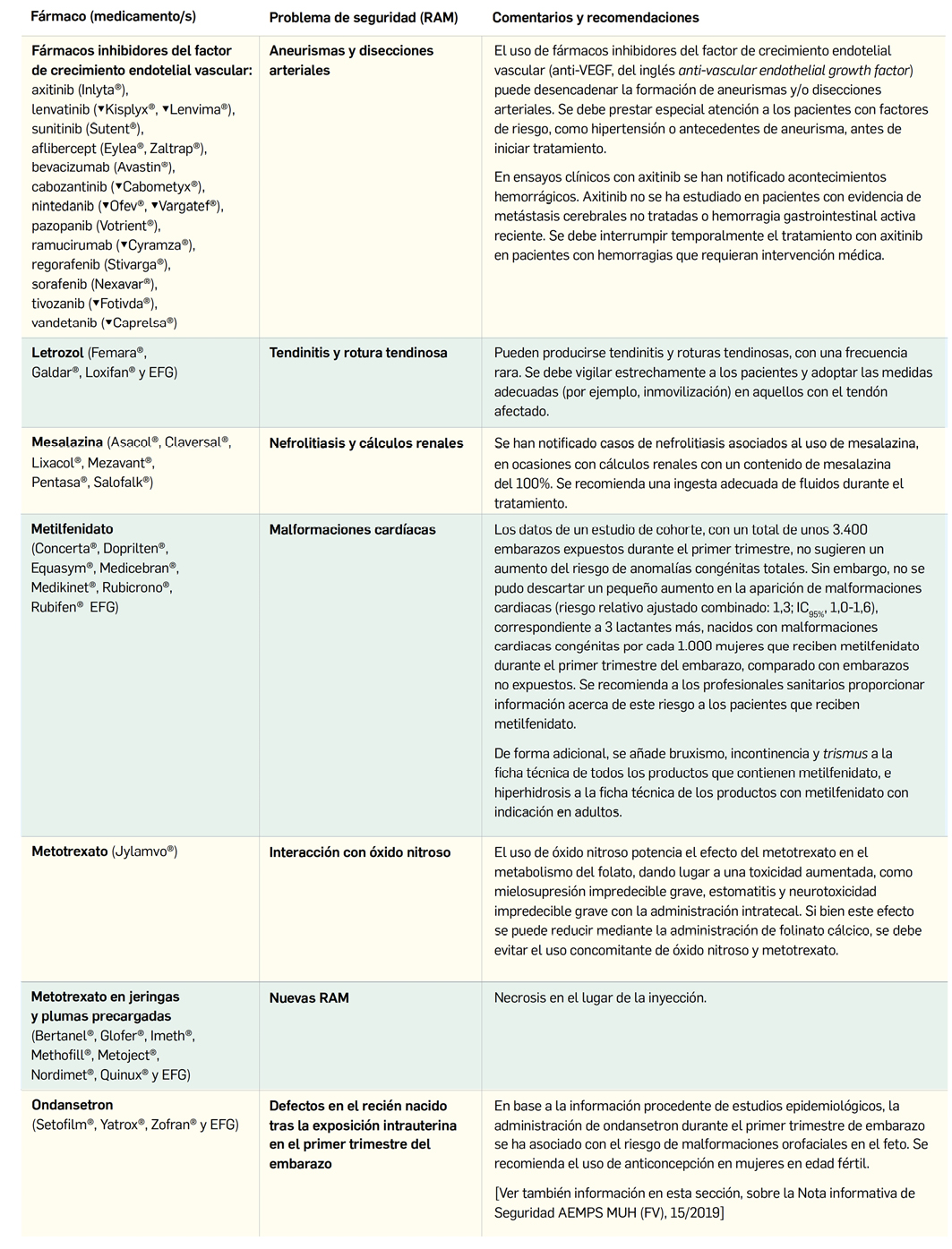
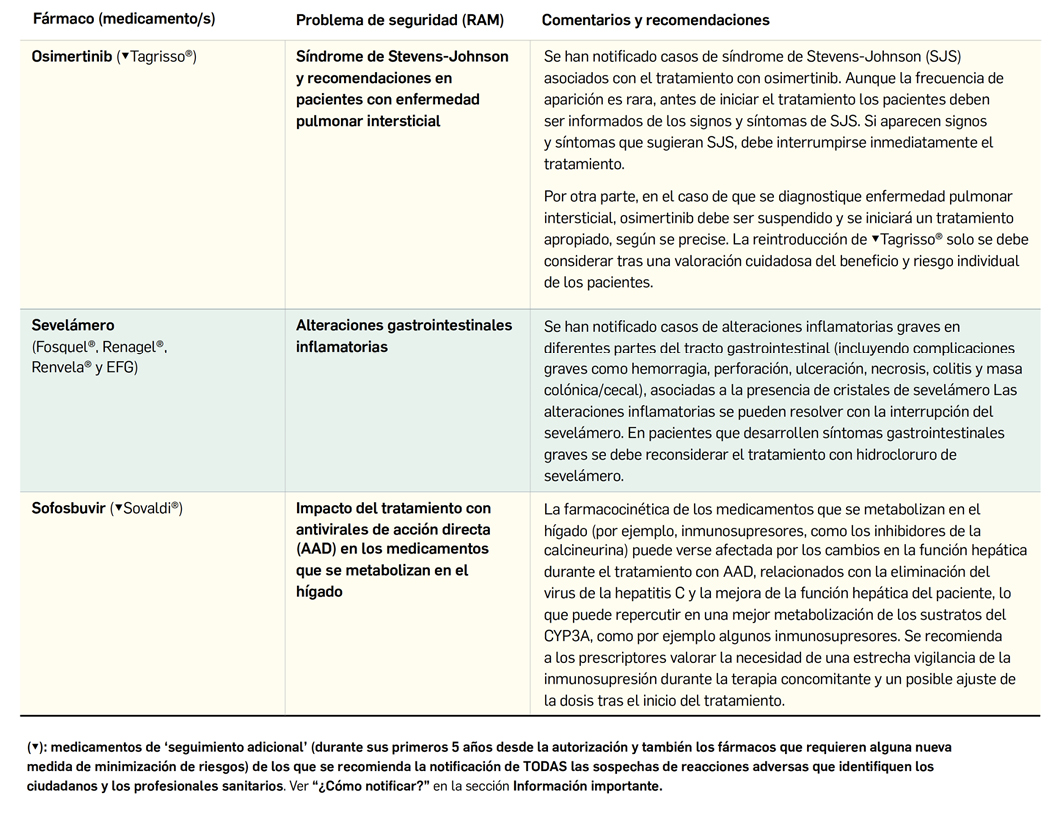
1 Agencia Española de Medicamentos y Productos Sanitarios (AEMPS). Nueva información de seguridad procedente de la evaluación periódica de los datos de farmacovigilancia. Boletín Mensual de la AEMPS sobre Medicamentos de uso Humano, Julio 2019. Publicado el 8 de octubre de 2019, páginas 10 a 13. Disponible en: https://www.aemps.gob.es/informa/boletines-AEMPS/boletinMensual/2019/julio/docs/boletin-mensual-MUH_julio-2019.pdf?x97173 (consultado 6 de noviembre de 2019).
Artículos relacionados
-
2 Abr 2025Paracetamol en Europa: riesgo de acidosis metabólica con desequilibrio aniónico alto Actualidad
-
2 Abr 2025Información de seguridad procedente de la evaluación periódica de los datos de farmacovigilancia que decide el Comité Europeo para la Evaluación de Riesgos en Farmacovigilancia (PRAC) Actualidad
-
27 Feb 2025Testosterona: riesgo potencial de fibrilación auricular Actualidad




