Cabozantinib ▼ Cabometyx® (Ipsen) en carcinoma renal de células claras
 Nº406
Nº406
Resumen
Cabozantinib es un inhibidor múltiples receptores de tipo tirosina cinasa implicados en el crecimiento tumoral y la angiogénesis, la remodelación ósea patológica, la quimiorresistencia y la progresión metastásica del cáncer, especialmente receptores de MET y VEGF. Asimismo, inhibe otras tirosina cinasas, como el receptor GAS6 (AXL), RET, ROS1, TYRO3, MER, el receptor del factor de células madre (KIT), TRKB, la tirosina cinasa 3 tipo Fms (FLT3) y TIE-2. El medicamento ha sido autorizado para el tratamiento del carcinoma de células renales (CCR) avanzado en adultos después del tratamiento con una terapia previa dirigida al factor de crecimiento del endotelio vascular VEGF). La eficacia y la seguridad clínicas del cabozantinib han sido adecuadamente contrastadas en la indicación autorizada mediante un ensayo clínico de fase 3, abierto, aleatorizado y controlados con everolimús (METEOR), comparándolos en pacientes con carcinoma renal de células claras avanzado cuya enfermedad había progresado durante o después de un tratamiento previo con inhibidores de la tirosina cinasa activos sobre VEGFR (VEGFR-TKI). Los resultados mostraron que cabozantinib es prolonga el tiempo de supervivencia sin progresión tumoral en 3,6 meses más que everolimús (7,4 vs 3,8); una prolongación que, aunque modesta, es clínicamente relevante dadas las características de este tipo de pacientes. Además, el cabozantinib demostró una reducción estadísticamente significativa del 34% en la tasa de muerte en comparación con el everolimús, con una supervivencia global media de 21,4 vs 16,5 meses, lo que implica una mejora de 4,9 meses. Los eventos adversos emergentes durante el tratamiento fueron más frecuentes con cabozantinib que con everolimús. En este sentido, los más comunes de grado 3 o superior fueron hipertensión (15 vs 4% en el grupo everolimús), diarrea (13 vs 2%), fatiga (11 vs 7%) y síndrome de eritrodisestesia palmar-plantar (8 vs 1%). Por otro lado, un mayor porcentaje de pacientes tratados con cabozantinib precisaron reducciones de dosis e interrupción de tratamiento en relación a everolimús, si bien el balance beneficio/riesgo de cabozantinib es considerado como aceptable, ya que la mayoría de los eventos adversos respondieron a tratamiento estándar o a reducción de la dosis. En definitiva, el cabozantinib es una alternativa más eficaz – aunque algo más tóxica – que el everolimús. Actualmente, en este sentido, puede considerarse como un tratamiento de referencia en este tipo de pacientes, aunque cabe indicar que el cabozantinib no se ha evaluado en pacientes con metástasis cerebrales, considerando que la segunda causa de metástasis cerebrales son tumores de células renales. Según el Informe de Posicionamiento Terapéutico, el uso de cabozantinib se debe considerar como una alternativa a nivolumab en la misma línea de tratamiento, siendo ambos opciones preferentes frente a everolimús o axitinib.
ASPECTOS FISIOPATOLÓGICOS
Los tumores de riñón suponen alrededor del 3% de la incidencia global enfermedades neoplásicas a escala mundial, siendo responsables de un porcentaje similar de las muertes de origen tumoral. El carcinoma de células renales es la forma más común de cáncer renal. Mayoritariamente (75-80%), se trata de adenocarcinomas del parénquima que recubre los túbulos renales, en tanto que el resto afecta a la pelvis renal, fundamentalmente carcinomas de células transicionales. Anualmente se diagnostican alrededor de más de 65.000 nuevos casos de carcinoma de células renales en la Unión Europea, con una prevalencia quinquenal de unos 230.000 casos, produciéndose cerca de 30.000 muertes relacionadas con él. En España se diagnostican cerca de 7.000 nuevos casos cada año. A nivel mundial, la incidencia anual roza los 300.000 casos.
Se suele presentar a partir de los 50 años de edad (70-75% de los casos), con una edad media en el momento del diagnóstico de 64 años, siendo la incidencia doble en hombres que en mujeres. El 30% de los nuevos diagnósticos se producen ya en fase metastásica; por otro lado, un 20-40% de los cuadros diagnosticados en fases tumorales localizadas acabarán desarrollando metástasis.
Los factores de riesgo más importantes para el desarrollo del adenocarcinoma renal son el tabaquismo y la obesidad, así como la enfermedad quística renal asociada a la diálisis. Asimismo, determinadas profesiones como la metalurgia, los pintores y los bomberos tienen una mayor asociación con esta forma de cáncer. El carcinoma renal se clasifica en función del tipo celular y el patrón de crecimiento (acinar, papilar o sarcomatoide). Frecuentemente, el tumor de renal tiene más de un tipo celular, aunque es el tipo predominante el que determina la clasificación de la neoplasia. Un 2-4% de los casos tienen un origen hereditario y su forma más conocida es la asociada al síndrome de Von Hippel-Lindau1.
Entre los cinco tipos principales de carcinoma de células renales el carcinoma de células claras es la forma más común (80%), siendo el carcinoma renal papilar o cromofílico el segundo tipo más común (10-15%). Estos cánceres forman dedos pequeños o papilas, parecidos a proyecciones, en parte o incluso distribuido por todo el tumor. Por su parte, el carcinoma renal de células cromófobas es el tercer tipo más común (5%), consistente en células pálidas, como el de células claras, aunque son mucho más grandes y con ciertas particularidades. El cuarto tipo es el carcinoma renal del túbulo colector, muy raro, cuya característica principal consiste en que las células cancerosas forman conductos irregulares. Finalmente, el restante 5% de los cánceres renales tienen una apariencia que no corresponde a ninguna de las otras categorías mencionadas.
El comportamiento y la evolución del adenocarcinoma de riñón son poco predecibles e incluso se han descrito remisiones espontáneas; asimismo, en algunas ocasiones el tumor no llega a expresarse clínicamente y pasa desapercibido. No obstante, en muchos casos, el tumor acaba con la vida del paciente en un periodo relativamente corto de tiempo. Entre un 20% y un 30% de los pacientes presentan metástasis en el momento del diagnóstico y otro 10-30% son portadores de micrometástasis que se manifestarán en un intervalo de tiempo variable tras la nefrectomía radical. El tumor crece de forma local, invadiendo las estructuras renales y los tejidos de alrededor. La diseminación a distancia suele producirse por vía sanguínea, haciendo metástasis fundamentalmente en pulmón, hígado, cápsula suprarrenal, hueso y cerebro.
El pronóstico empeora con la edad y conforme aumenta el tamaño tumoral, debido a la infiltración de los órganos vecinos y formación de metástasis distales. Los tumores confinados al riñón tienen un buen pronóstico, con una supervivencia a los cinco años en torno al 80%, que alcanza el 90% en los pacientes con tumores de un tamaño inferior a 5 cm en el momento del diagnóstico, aunque este porcentaje desciende al 50-60% en aquellos con mayor tamaño. Si hay afectación extrarrenal próxima, hacia la vena cava o los ganglios linfáticos locales, la supervivencia a los cinco años es del 40-50%, pero desciende por debajo del 15% (8-23%) en los pacientes con metástasis distales. Las localizaciones más comunes de las metástasis de origen renal son pulmones, mediastino, huesos, hígado y cerebro; de hecho, entre los tumores sólidos, el carcinoma de células renales es el segundo en frecuencia en cuanto a metástasis cerebrales.
La aparición tardía de recaídas tras la nefrectomía en muchos de los pacientes con tumores localmente localizados, así como de estabilizaciones prolongadas y de remisiones ocasionales de la enfermedad en ausencia de tratamientos sistémicos, sugiere un papel particularmente relevante de los mecanismos inmunitarios en la regulación del crecimiento celular en este tipo tumoral.
Una de las características típicas del carcinoma de células renales es la inactivación de la proteína supresora tumoral von Hippel-Landau (VHL), que se traduce en una desregulación de la vía de señalización del Factor de Crecimiento del Endotelio Vascular (VEGF, vascular endotelial growth factor). Los diversos tipos de receptores del VEGF (VEGFR) contienen dominios intracelulares consistentes en tirosina cinasas y su activación – especialmente a través del VEGFR-2 – promueve el crecimiento de vasos sanguíneos en los tumores sólidos (neoangiogénesis). Otras vías de señalización bioquímicas que aparecen frecuentemente alteradas en las células de los carcinomas de células claras renales deficientes de VHL son MET y AXL.
El supresor tumoral VHL se inactiva por mutación o silenciamiento epigenético en aproximadamente el 80% de los casos esporádicos de carcinoma renal de células claras (CRCC). La deficiencia de VHL en CRCC impulsa la angiogénesis, la invasión local y la metástasis mediante la activación de la respuesta hipóxica regulada por el factor inducible por hipoxia (hypoxia-inducible factor, HIF). A concentraciones bajas de oxígeno, los factores de transcripción HIF1α/HIF2α inducen la expresión de genes de respuesta hipóxica incluyendo factores angiogénicos tales como VEGF y PDGF (factor de crecimiento derivado de plaquetas; Platelet-derived Growth Factor), proteínas pro-invasoras que promueven la transición epitelial-mesenquimal y enzimas que facilitan el metabolismo anaeróbico. En condiciones normales (normoxia), VHL canaliza a HIF1α/HIF2α para su degradación dependiente de ubiquitina por el proteasoma. Sin embargo, la pérdida de la función VHL conduce a la estabilización de los factores de transcripción HIF y la consiguiente expresión de sus genes diana. En células tumorales deficientes en VHL y células endoteliales, el HIF2α es considerado como el principal regulador positivo de la tumorigénesis y la angiogénesis. Precisamente, la activación de la señalización de VEGFR y PDGF como resultado de la deficiencia de VHL subyace a la actividad clínica de agentes antiangiogénicos en CRCC.
MET (c-Met) es la proteína receptora – se trata también de una tirosina cinasa – del factor de crecimiento de hepat ocitos (hepatocyte growth factor, HGF), el cual induce la activación del gen GAB1, que codifica la proteína 1 asociada a GRB2, la cual es un importante mediador de la tubulogénesis celular y juega un papel central en el crecimiento, transformación y apoptosis celular. MET se expresa normalmente las células de origen epitelial, mientras que la expresión de HGF se limita a las células de origen mesenquimal. Normalmente, sólo las células pluripotenciales (células madre) y células progenitoras expresan MET, lo que permite que estas células crezcan naturalmente de forma invasiva con el fin de generar nuevos tejidos en un embrión o regenerar los tejidos dañados en un adulto. Sin embargo, se piensa que las células madre tumorales secuestran esta capacidad de las células madre normales para expresar el MET, favoreciendo la persistencia tumoral y la propagación a otros sitios en el cuerpo. La activación anormal del MET en el cáncer se correlaciona con un mal pronóstico, ya que la vía MET aberrantemente activa desencadena el crecimiento tumoral, la formación de nuevos vasos sanguíneos tumorales (neoangiogénesis) y la diseminación a otros órganos (metástasis); de hecho, se ha confirmado que la vía MET está desregulada en muchos tipos de neoplasias humanas, incluyendo cánceres de riñón, hígado, estómago, mama y cerebro.
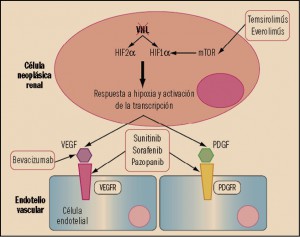
Por su parte, el gen AXL codifica una proteína receptora con actividad tirosina cinasa que traslada señales bioquímicas de la matriz extracelular al interior celular mediante la unión a la proteína GAS6 (Growth arrest-specific 6), implicada en la estimulación de la proliferación, supervivencia, angiogénesis y apoptosis tumoral. La proteína AXL fue identificada en primer lugar en pacientes con leucemia mielógena crónica, aunque su sobreexpresión ha sido observada igualmente en glioblastomas, melanomas, osteosarcomas, leucemias eritroides y megacariocíticas, así como en cánceres de útero, colon, próstata, tiroides, ovario e hígado; igualmente, la sobreexpresión de la AXL se correlaciona con las metástasis e invasiones de un cierto número de tumores, incluyendo el carcinoma de células renales, los glioblastoma, y los cánceres de mama, pulmón y próstata. Por otro lado, la expresión de la AXL aumenta como respuesta a los fármacos quimioterápicos, confiriendo resistencia a estos en los tumores de estromas gastrointestinales (GIST) y en la leucemia mieloide aguda. Además, la AXL juega también un importante papel en la transición de epitelial a mesenquimatoso en el cáncer de mama, una transición clave para la inducción de metástasis.
El tratamiento del cáncer renal de células claras depende de la extensión de la enfermedad. En los estadios localizados (T1 y T2) o con afectación de vena renal o grasa perirrenal (T3), la cirugía, ya sea radical (extirpación completa del riñón, la grasa perirrenal, la suprarrenal homolateral y los ganglios regionales) o parcial (en tumores menores de 4 cm), continúa siendo el único tratamiento curativo. La posibilidad de realizar la cirugía con técnica laparoscópica aporta una disminución del dolor postoperatorio, un tiempo de hospitalización menor y una recuperación más rápida. La radioterapia no es efectiva en ninguno de los estadios del cáncer renal y sólo se puede plantear con finalidad paliativa (control del dolor por el tumor primario o las metástasis óseas o del sangrado).
La utilidad de la quimioterapia se centra en los pacientes con tumores que presentan metástasis en el momento del diagnóstico y en los pacientes en los que el tumor reaparece incluso años después de haber sido tratados con cirugía. La quimioterapia convencional es prácticamente ineficaz en el cáncer renal, por lo que este tumor es considerado como quimiorresistente. Pueden seguirse dos estrategias: la inmunoterapia o la terapia dirigida. En el caso de enfermedad avanzada o metastásica, el cáncer de riñón es el único tumor en el que está indicada la realización de cirugía para reducir masa tumoral antes de realizar tratamiento con fármacos, siempre que el estado general del paciente lo permita.
La inmunoterapia es un tipo de terapia biológica que estimula el sistema inmunitario del paciente para que actúe contra las células tumorales. Se emplean sustancias elaboradas por el propio organismo o administradas por vía parenteral, así como el empleo de vacunas dendríticas alogénicas (todavía en fase experimental). La inmunoterapia con interferón alfa y/o interleucina 2 (IL-2), iniciada hace más de 20 años, despertó muchas esperanzas, alcanzando respuestas objetivas en alrededor del 20% de los casos con cáncer metastásico; sin embargo, su tasa de respuesta objetiva es baja y poco persistente; además, son tratamientos – en especial, la aldesleucina – particularmente tóxicos. El interferón alfa induce la producción de citocinas que estimulan la actividad antitumoral de las células citotóxicas mientras que la interleucina 2 (IL-2; aldesleucina) es un factor de crecimiento y diferenciación para los linfocitos T y las células NK (natural killers) que inducen y mantienen la citotoxicidad no específica contra las células tumorales (inmunidad inespecífica).
En general, el uso de interferón alfa y de aldesleucina ha ido trasladándose sustancialmente hacia la terapia dirigida, debido a una mejor y más persistente respuesta antitumoral, así como a disponer de perfiles toxicológicos significativamente mejor tolerados por los pacientes. La terapia dirigida se realiza con fármacos diseñados para actuar específicamente sobre puntos concretos del ciclo biológico de las células renales tumorales, limitando sus efectos adversos sobre las células normales. Se pueden dividir en 3 grupos:
- Inhibidores de tirosina cinasas:
- El sunitinib fue el primer fármaco de este grupo en recibir la autorización en esta indicación. Inhibe múltiples receptores de tipo tirosina cinasa (RTK) que están implicados en el crecimiento tumoral, la neoangiogénesis y la progresión a metástasis del cáncer. En concreto se identificó como un inhibidor de los receptores del factor de crecimiento derivado de plaquetas (PDGFRα y PDGFRβ), de los receptores de los factores de crecimiento del endotelio vascular (VEGFR1, VEGFR2 y VEGFR3), del receptor de factor de células madre (KIT), de la tirosina cinasa 3 tipo Fms (FLT3), del factor estimulador de colonias (CSF-1R), y del receptor del factor neurotrófico derivado de la línea celular glial (RET).
- El sorafenib es un inhibidor de las raf cinasas, que bloquea las señales de los oncogenes Ras, c-KIT y RET y bloquea asimismo la activación de otros receptores con actividad tirosina cinasa implicados en la neovascularización y la progresión del tumor (entre otros, VEGFR-2, VEGFR-3 o los del factor de crecimiento derivado de plaquetas –PDGF–).
- El pazopanib es un inhibidor multicinasa de la angiogénesis a través de la inhibición de los receptores VEGFR y PDGFR y c-KIT. También tiene una discreta acción sobre el receptor del FGF (fibroblast growth factor) y otras diversas cinasas.
- El axitinib actúa inhibiendo potente y selectivamente las cinasas que forman parte de los receptores 1, 2 y 3 del factor de crecimiento endotelial vascular VEGF (VEGFR-1, 2 y 3), tanto en sus formas fosforiladas como no fosforiladas (en particular, estas últimas), que están implicados en los procesos de neovascularización y la progresión tumoral. También es un potente inhibidor de la cinasa del receptor del factor de crecimiento derivados de plaquetas (PFGDR).
- El cabozantinib es el último agente incorporado. Se trata un inhibidor múltiples receptores de tipo tirosina cinasa, especialmente receptores de MET y VEGF. Asimismo, inhibe otras tirosina cinasas, como el receptor GAS6 (AXL), RET, ROS1, TYRO3, MER, el receptor del factor de células madre (KIT), TRKB, la tirosina cinasa 3 tipo Fms (FLT3) y TIE-2.
- Inhibidores de la mTOR (diana de rapamicina en células de mamífero; mammalian Target of Rapamycin):
- El everolimús y el temserolimús se unen a la proteína intracelular FKBP-12, uniéndose el complejo resultante de forma selectiva a mTOR, una serina/treonina cinasa implicada en la traducción de proteínas reguladoras del ciclo celular, interrumpiendo así la división celular en G1. La familia de proteínas TOR está implicada en el control del inicio de la transcripción del ARNm, la organización del citoesqueleto celular de actina, el tráfico de membrana, la formación de ribosomas y la regulación del crecimiento, proliferación y muerte celular. Se utilizan en cáncer renal metastásico que hayan fracasado al tratamiento inicial con otros fármacos antiangiogénicos (sorafenib, sunitinib, bevacizumab).
- Anticuerpos monoclonales:
- El bevacizumab se une de forma específica al VEGF, impidiendo la unión de éste a sus receptores (VEGFR), inhibiendo así la formación de nuevos vasos sanguíneos (acción antiangiogénica) que son imprescindibles para el crecimiento tumoral.
- El nivolumab se une al receptor de muerte programada 1 (PD-1) y bloquea su interacción con sus ligandos naturales (PD-L1 y PD-L2). El receptor PD-1 es un regulador negativo de la actividad de los linfocitos T, que está implicado en el control de la respuesta inmunitaria antitumoral. Está indicado en monoterapia para el tratamiento de carcinoma de células renales (CCR) avanzado después de tratamiento previo, en adultos
ACCIÓN Y MECANISMO
Cabozantinib es un inhibidor múltiples receptores de tipo tirosina cinasa implicados en el crecimiento tumoral y la angiogénesis, la remodelación ósea patológica, la quimiorresistencia y la progresión metastásica del cáncer, especialmente receptores de MET y VEGF. Asimismo, inhibe otras tirosina cinasas, como el receptor GAS6 (AXL), RET, ROS1, TYRO3, MER, el receptor del factor de células madre (KIT), TRKB, la tirosina cinasa 3 tipo Fms (FLT3) y TIE-2. El medicamento está indicado para el tratamiento del carcinoma de células renales (CCR) avanzado en adultos después del tratamiento con una terapia previa dirigida al factor de crecimiento del endotelio vascular VEGF).
Una de las características típicas del carcinoma de células renales es la inactivación de la proteína supresora tumoral von Hippel-Landau (VHL), que se traduce en una desregulación de la vía de señalización del Factor de Crecimiento del Endotelio Vascular (VEGF, vascular endotelial growth factor). Los diversos tipos de receptores del VEGF (VEGFR) contienen dominios intracelulares consistentes en tirosina cinasas y su activación – especialmente a través del VEGFR-2 – promueve el crecimiento de vasos sanguíneos en los tumores sólidos (neoangiogénesis). Otras vías de señalización bioquímicas que aparecen frecuentemente alteradas en las células de los carcinomas de células claras renales deficiente de VHL son MET y AXL.
El supresor tumoral VHL se inactiva por mutación o silenciamiento epigenético en aproximadamente el 80% de los casos esporádicos de carcinoma renal de células claras (CRCC). La deficiencia de VHL en CRCC impulsa la angiogénesis, la invasión local y la metástasis mediante la activación de la respuesta hipóxica regulada por el factor inducible por hipoxia (hypoxia-inducible factor, HIF). A concentraciones bajas de oxígeno, los factores de transcripción HIF1α/HIF2α inducen la expresión de genes de respuesta hipóxica incluyendo factores angiogénicos tales como VEGF y PDGF (factor de crecimiento derivado de plaquetas; Platelet-derived Growth Factor), proteínas pro-invasoras que promueven la transición epitelial-mesenquimal y enzimas que facilitan el metabolismo anaeróbico. En condiciones normales (normoxia), VHL dirige a HIF1α/HIF2α para su degradación dependiente de ubiquitina por el proteasoma. Sin embargo, la pérdida de la función VHL conduce a la estabilización de los factores de transcripción HIF y la consiguiente expresión de sus genes diana. En células tumorales deficientes en VHL y células endoteliales el HIF2α es el principal regulador positivo de la tumorigénesis y la angiogénesis, en lugar de HIF1α. La activación de la señalización de VEGFR como resultado de la deficiencia de VHL subyace a la actividad clínica de agentes antiangiogénicos en CRCC.
MET (c-Met) es la proteína receptora – se trata también de una tirosina cinasa – del factor de crecimiento de hepatocitos (hepatocyte growth factor, HGF), el cual induce la activación del gen GAB1, que codifica la proteína 1 asociada a GRB2, la cual es un importante mediador de la tubulogénesis celular y juega un papel central en el crecimiento, transformación y apoptosis celular. MET se expresa normalmente las células de origen epitelial, mientras que la expresión de HGF se limita a las células de origen mesenquimal. Normalmente, sólo las células pluripotenciales (células madre) y células progenitoras expresan MET, lo que permite que estas células crezcan de forma invasiva con el fin de generar nuevos tejidos en un embrión o regenerar los tejidos dañados en un adulto. Sin embargo, se piensa que las células madre tumorales secuestran la capacidad de las células madre normales para expresar el MET, y así favorecer la persistencia tumoral y la propagación a otros sitios en el cuerpo. La activación anormal del MET en el cáncer se correlaciona con un mal pronóstico, ya la vía MET aberrantemente activa desencadena el crecimiento tumoral, la formación de nuevos vasos sanguíneos tumorales (neoangiogénesis) y la diseminación a otros órganos (metástasis); de hecho, se ha confirmado que la vía MET está desregulada en muchos tipos de neoplasias humanas, incluyendo cánceres de riñón, hígado, estómago, mama y cerebro.
Por su parte, el gen AXL codifica una proteína receptora de tipo tirosina cinasa que traslada señales bioquímicas de la matriz extracelular al interior celular mediante la unión a la proteína GAS6 (Growth arrest-specific 6), implicada en la estimulación de la proliferación, supervivencia, angiogénesus y apoptosis tumoral. La proteína AXL fue identificada en primer lugar en pacientes con leucemia mielógena crónica, aunque su sobreexpresión ha sido observada igualmente en glioblastomas, melanomas, osteosarcomas, leucemias eritroides y megacariocíticas, así como en cánceres de útero, colon, próstata, tiroides, ovario e hígado; igualmente, la sobreexpresión de la AXL se correlaciona con las metástasis e invasiones de un cierto número de tumores, incluyendo el carcinoma de células renales, los glioblastoma, y los cánceres de mama, pulmón y próstata. Por otro lado, la expresión de la AXL aumenta como respuesta a los fármacos quimioterápicos, confiriendo resistencia a estos en los cánceres de estromas gastrointestinales y en la leucemia mieloide aguda. Además, la AXL juega también un importante papel en la transición de epitelial a mesenquimatoso en el cáncer de mama, una transición clave para la inducción de metástasis.
ASPECTOS MOLECULARES
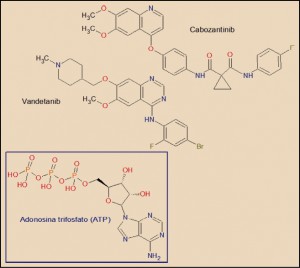
El cabozantinib está estrechamente relacionado estructural y farmacológicamente con otros miembros de la serie de inhibidores de proteína cinasas y, en particular con el vandetanib. Como otros miembros de la serie de inhibidores de proteína cinasas, es el resultado de la optimización funcional mediante modelización molecular a partir de una serie de 2-fenilaminopirimidinas, de donde surgió el imatinib, cabeza de serie del grupo. En cualquier caso, todos ellos guardan – en mayor o menor grado – una familiaridad química con la molécula de ATP (o, en su caso, con la de GTP, como sucede en las cinasas MAPK), con la que compiten para provocar el bloqueo de la cinasa correspondiente.
EFICACIA Y SEGURIDAD CLÍNICAS
La eficacia y la seguridad clínicas del cabozantinib han sido adecuadamente contrastadas en la indicación autorizada mediante un ensayo clínico de fase 3, confirmatorio de eficacia y seguridad, abierto, aleatorizado y controlados con everolimús (METEOR; Choueiri, 2015 y 2016), comparándolos en pacientes con carcinoma renal de células claras avanzado cuya enfermedad había progresado durante o después de un tratamiento previo con inhibidores de la tirosina cinasa activos sobre VEGFR (VEGFR-TKI). Los requisitos de elegibilidad incluyeron edad ≥ 18 años, diagnóstico histológico, enfermedad mensurable según RECIST2 y un índice de Karnofsky3 ≥ 70. Los pacientes que habían recibido tratamiento previo con inhibidores de mTOR (everolimús, tacrolimús) no eran elegibles.
El estudio fue diseñado para proporcionar el poder adecuado para la evaluación tanto de la variable clínica primaria de supervivencia libre de progresión tumoral (SLP) como las secundarias de supervivencia global (SG) y tasa de respuesta objetiva (TRO). El estudio fue diseñado para inscribir a 650 pacientes, con un análisis primario planificado de SLP en los primeros 375 pacientes aleatorizados (la población primaria de SLP) después de 259 eventos y un análisis secundario de supervivencia global en los 650 pacientes después de 408 eventos. Un total de 658 pacientes (la población por intención de tratar) fueron asignados al azar para recibir un tratamiento abierto con cabozantinib (N = 330) o everolimús (N = 328). La aleatorización fue estratificada por el número de usos anteriores de inhibidores de tirosina cinasas anti-VEGFR y los grupos de riesgo (Memorial Sloan Kettering Cancer Center; MSKCC). El tratamiento se administró por vía oral; el cabozantinib se inició con 60 mg/24 h y el de everolimús con 10 mg/24 h. El protocolo especificó interrupciones o reducciones de dosis según se necesitaban para manejar los eventos adversos emergentes del tratamiento. No se permitió el cruce entre los brazos de tratamiento.
Las características basales de los pacientes estaban equilibradas. La mayoría (71%) había recibido sólo un VEGFR-TKI previo, siendo los más comunes sunitinib (63%) y pazopanib (43%). En particular, 31 pacientes (5%) habían recibido tratamiento previo con nivolumab. Se reportaron metástasis óseas en el 22% de los pacientes y visceral en el 74%. La mayoría de los pacientes se clasificaron como de riesgo favorable (46%) o intermedio (42%) según los criterios pronósticos del MSKCC.
En el punto de corte de datos para el primer análisis intermedio, el tiempo mínimo de seguimiento fue de 11 meses. En este punto, el tratamiento con cabozantinib mejoró significativamente la SLP en comparación con el everolimús con una mediana de 7,4 vs 3,8 meses (tasa de riesgo, HR = 0,58; IC95% 0,45 a 0,75; p < 0,001). La evaluación de la respuesta por un comité independiente de revisión de radiología mostró un TRO de 17% para cabozantinib versus 3% para everolimús (p < 0,0001), siendo todas respuestas parciales; adicionalmente, la estabilización tumoral se reportó como la mejor respuesta global en el 65% de los pacientes tratados con cabozantinib y el 62% de los pacientes tratados con everolimús, mientras que se encontró enfermedad progresiva en el 12% de los pacientes tratados con cabozantinib y en el 27% de los pacientes tratados con everolimús. En el segundo punto de corte de datos, se dispuso de datos suficientes para el análisis de la supervivencia global, con un seguimiento mínimo de 13 meses; en este sentido, el cabozantinib demostró una reducción del 34% en la tasa de muerte en comparación con el everolimús, con una supervivencia global media de 21,4 vs 16,5 meses (HR = 0,66, IC95% 0,53 a 0,83; p = 0,00026).
El análisis de subgrupos de la población del estudio mostró una marcada mejoría para los pacientes con metástasis óseas tratados con cabozantinib vs everolimús, tanto para la SLP (HR = 0,33; IC95% 0,21 a 0,51) como para la supervivencia global (HR = 0,54; IC95% 0,34 a 0,84). Además, la tasa de eventos relacionados con el esqueleto fue del 16% para el brazo de cabozantinib vs 34% para el brazo de everolimús entre aquellos con antecedentes de eventos relacionados con el esqueleto al inicio del estudio. Igualmente, cabozantinib demostró mejoras con respecto al everolimús para la supervivencia libre de progresio (SLP) y la supervivencia global (SG) a través de múltiples subgrupos, incluyendo aquellos definidos por el número de VEGFR-TKI previos (1 o ≥ 2), por la duración del tratamiento con el primer VEGFR-TKI (≤ 6 ó > 6 meses), con sunitinib o pazopanib como el único VEGFR-TKI y por tratamiento previo con un inhibidor PD-1.
El análisis de seguridad de todos los eventos adversos emergentes (EAE) durante el tratamiento mostró que el 21% de los pacientes que recibieron cabozantinib experimentaron un evento adverso de grado 1/2 vs 32% para los que recibieron everolimús, los de grado 3 aparecieron en el 63 vs 52% y los de grado 4 se registraron en el 8% en ambos brazos de tratamiento. Los EAE de grado 3 más comunes experimentados por los pacientes del grupo de cabozantinib fueron hipertensión (15 vs 4% en el grupo everolimús), diarrea (13 vs 2%), fatiga (11 vs 7%) y síndrome de eritrodisestesia palmar-plantar (8 vs 1%). El evento de grado 4 más frecuente en el brazo de cabozantinib fue hipomagnesemia (3 vs 0%); el resto los eventos de grado 4 tuvieron una frecuencia < 1%. Se utilizaron reducciones de la dosis para controlar los eventos adversos en el 62% de los pacientes del brazo de cabozantinib y en el 25% de los pacientes del brazo everolimús. Las muertes relacionadas con el tratamiento fueron raras en ambos brazos: una muerte en el brazo de cabozantinib (no especificado por el investigador) y dos en el brazo everolimús (una por infección por aspergillus y otra por neumonía por aspiración).
ASPECTOS INNOVADORES
Cabozantinib es un inhibidor múltiples receptores de tipo tirosina cinasa implicados en el crecimiento tumoral y la angiogénesis, la remodelación ósea patológica, la quimiorresistencia y la progresión metastásica del cáncer, especialmente receptores de MET y VEGF. Asimismo, inhibe otras tirosina cinasas, como el receptor GAS6 (AXL), RET, ROS1, TYRO3, MER, el receptor del factor de células madre (KIT), TRKB, la tirosina cinasa 3 tipo Fms (FLT3) y TIE-2. El medicamento ha sido autorizado para el tratamiento del carcinoma de células renales (CCR) avanzado en adultos después del tratamiento con una terapia previa dirigida al factor de crecimiento del endotelio vascular VEGF).
La eficacia y la seguridad clínicas del cabozantinib han sido adecuadamente contrastadas en la indicación autorizada mediante un ensayo clínico de fase 3, abierto, aleatorizado y controlados con everolimús (METEOR), comparándolos en pacientes con carcinoma renal de células claras avanzado cuya enfermedad había progresado durante o después de un tratamiento previo con inhibidores de la tirosina cinasa activos sobre VEGFR (VEGFR-TKI). Los resultados mostraron que cabozantinib es prolonga el tiempo de supervivencia sin progresión tumoral en 3,6 meses más que everolimús (7,4 vs 3,8); una prolongación que, aunque modesta, es clínicamente relevante dadas las características de este tipo de pacientes. Además, el cabozantinib demostró una reducción estadísticamente significativa del 34% en la tasa de muerte en comparación con el everolimús, con una supervivencia global media de 21,4 vs 16,5 meses, lo que implica una mejora de 4,9 meses.
Los eventos adversos emergentes durante el tratamiento fueron más frecuentes con cabozantinib que con everolimús. En este sentido, los más comunes de grado 3 o superior fueron hipertensión (15 vs 4% en el grupo everolimús), diarrea (13 vs 2%), fatiga (11 vs 7%) y síndrome de eritrodisestesia palmar-plantar4 (8 vs 1%). El evento de grado 4 más frecuente con cabozantinib fue hipomagnesemia (3 vs 0%); el resto de los eventos de grado 4 tuvieron una frecuencia < 1%. Por otro lado, un mayor porcentaje de pacientes tratados con cabozantinib precisaron reducciones de dosis e interrupción de tratamiento en relación a everolimús, si bien el balance beneficio/riesgo de cabozantinib es considerado como aceptable, ya que la mayoría de los eventos adversos respondieron a tratamiento estándar o a reducción de la dosis.
En definitiva, el cabozantinib es una alternativa más eficaz – aunque algo más tóxica – que el everolimús. Actualmente, en este sentido, puede considerarse como un tratamiento de referencia en este tipo de pacientes (Tannir, 2017), aunque cabe indicar que el cabozantinib no se ha evaluado en pacientes con metástasis cerebrales, considerando que la segunda causa de metástasis cerebrales son tumores de células renales.
La reciente autorización de esta misma indicación para el nivolumab enfatiza la importancia de determinar los criterios de elección entre este último y el cabozantinib. En este sentido, en un ensayo alesatorizado de fase 3 que comparó nivolumab con everolimús, el tratamiento con nivolumab mejoró significativamente la supervivencia global (HR = 0,73; IC95% 0,60 a 0,89; p = 0,0018), así como la tasa de respuestas objetivas, aunque no mejoró la supervivencia libre de progresión tumoral (Motzer, 2015).
Según el Informe de Posicionamiento Terapéutico (AEMPS, 2017), el uso de cabozantinib se debe considerar como una alternativa a nivolumab en la misma línea de tratamiento, siendo ambos opciones preferentes frente a everolimús o axitinib. Actualmente no están claramente definidas las situaciones en las que sería preferente usar nivolumab o cabozantinib. Por ello, la elección entre cabozantinib y su alternativa (nivolumab), se debe basar fundamentalmente en criterios de eficiencia. En cualquier caso, el tratamiento se debe mantener hasta que el paciente presente progresión radiológica, clínica o toxicidad inaceptable, lo que suceda antes.
|
VALORACIÓN |
|
CABOZANTINIB
|
|
Grupo Terapéutico (ATC): Tratamiento del carcinoma de células renales (CCR) avanzado en adultos después del tratamiento con una terapia previa dirigida al factor de crecimiento del endotelio vascular (VEGF). |
|
Indicaciones autorizadas: Tratamiento y profilaxis de hemorragias en pacientes con hemofilia B (deficiencia congénita de factor IX). |
|
INNOVACIÓN moderada. Aporta algunas mejoras, pero no implica cambios sustanciales en la terapéutica estándar. |
|
FÁRMACOS RELACIONADOS REGISTRADOS EN ESPAÑA |
|||
|
Fármaco |
Medicamento® |
Laboratorio |
Año |
|
Imatinib |
Glivec |
Novartis |
2002 |
|
Erlotinib |
Tarceva |
Roche |
2006 |
|
Sunitinib |
Sutent |
Pfizer |
2007 |
|
Dasatinib |
Sprycel |
Bristol Myers Squibb |
2007 |
|
Sorafenib |
Nexavar |
Bayer |
2007 |
|
Lapatinib |
Tyverb |
Glaxo |
2008 |
|
Nilotinib |
Tasigna |
Novartis |
2008 |
|
Gefitinib |
Iressa |
AstraZeneca |
2010 |
|
Pazopanib |
Votrient |
Glaxo |
2011 |
|
Crizotinib |
Xalkori |
Pfizer |
2014 |
|
Vemurafenib |
Zelboraf |
Roche |
2014 |
|
Dabrafenib |
Tafinlar |
GlaxoSmithKline |
2014 |
|
Axitinib |
Inlyta |
Pfizer |
2014 |
|
Afatinib |
Giotrif |
Boehringer Ingelheim |
2014 |
|
Ruxolitinib |
Jakavi |
Novartis |
2015 |
|
Vandetanib |
Caprelsa |
AstraZeneca |
2015 |
|
Regorafenib |
Stivarga |
Bayer |
2015 |
|
Nintedanib |
Ofev |
Boehringer Ingelheim |
2015 |
|
Ibrutinib |
Imbruvica |
Janssen Cilag |
2016 |
|
Trametinib |
Mekinist |
Novartis |
2016 |
|
Cobimetinib |
Cotellic |
Roche |
2016 |
|
Lenvatinib |
Lenvima |
Eisai |
2016 |
|
Bosutinib |
Bosulif |
Pfizer |
2017 |
|
Cabozantinib |
Cabometyx |
Ipsen |
2017 |
BIBLIOGRAFÍA
Bibliografía
- Agencia Española de Medicamentos y Productos Sanitarios (AEMPS). Informe de Posicionamiento Terapéutico de Cabozantinib (Cabometyx®) en carcinoma de células renales. IPT, 14/2017. V1 (8 de junio de 2017). Original disponible en: https://www.aemps.gob.es/medicamentosUsoHumano/informesPublicos/docs/IPT-cabozantinib-Cabometyx-cancer-renal.pdf
- Choueiri TK, Escudier B, Powles T, Mainwaring PN, Rini BI, Donskov F, et al. Cabozantinib versus everolimús in advanced renal-cell carcinoma. N Engl J Med. 2015; 373(19): 1814–23. doi: 10.1056/NEJMoa1510016.
- Choueiri TK, Escudier B, Powles T, Tannir NM, Mainwaring PN, Rini BI, et al. Cabozantinib versus everolimús in advanced renal cell carcinoma (METEOR): final results from a randomised, open-label, phase 3 trial. Lancet Oncol. 2016; 17(7): 917–27. doi: 10.1016/S1470-2045(16)30107-3.
- Cuéllar Rodríguez S. Axitinib (Inlyta®) en carcinoma de células renales. Panorama Actual Med 2014; 38(374): 487-93.
- European Medicines Agency (EMA). Cabometyx®. European Public Assessment Report (EPAR). EMA/664123/2016; EMEA/H/C/004163. Original disponible en: http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_-_Public_assessment_report/human/004163/WC500214070.pdf
- Motzer RJ, Escudier B, McDermott DF, George S, Hammers HJ, Srinivas S, et al. Nivolumab versus everolimus in advanced renal-cell carcinoma. N Engl J Med. 2015; 373(19): 1803–13. doi: 10.1056/NEJMoa1510665
- Tannir NM, Schwab G, Grünwald V. Cabozantinib: an Active Novel Multikinase Inhibitor in Renal Cell Carcinoma. Curr Oncol Rep. 2017; 19(2): 14. doi: 10.1007/s11912-017-0566-9.
1 Un síndrome hereditario de carácter autosómico dominante en el que los individuos afectados tienen riesgo de desarrollar tumores en diferentes órganos, entre los que se incluyen riñones, cerebelo, espina dorsal, oído interno, glándulas suprarrenales y páncreas. El gen implicado está localizado en la región 3p26 y se trata de un gen supresor.
2 Criterios de Evaluación de Respuesta en Tumores Sólidos (Response Evaluation Criteria In Solid Tumor; RECIST). Método estándar que se usa para medir el modo en que un paciente de cáncer responde al tratamiento. Permite determinar si los tumores se reducen, permanecen igual o se agrandan. Requiere un tumor que se pueda medir mediante radiografías, exploraciones por Tomografía Computadorizada (TC) o Resonancia Nuclear Magnética (RNM). Los tipos de respuesta que un paciente puede tener son: respuesta completa (RC), respuesta parcial (RP) enfermedad que avanza (EA) y enfermedad estable (EE).
3 El índice de Karnofsky (IK) es una escala funcional ampliamente utilizada en oncología y geriatría para predecir la evolución de los pacientes. Las puntuaciones oscilan entre 0 y 100, donde las más altas indican que el paciente tiene mayor capacidad para realizar las actividades cotidianas; en concreto, el cuestionario puntúa un total de 11 medidas para describir las habilidades del paciente. La interpretación de la puntuación total es: ≥ 90: paciente asintomático y con actividad normal; 89-70: sintomático, pero ambulatorio; 69-50: sintomático, levantado durante más del 50% de las horas de vigilia; 49-30: sintomático, sentado o en cama más del 50% del día; < 30: permanentemente encamado o confinado a una silla; 0: muerte.
4 Síndrome mano-pie, caracterizado por urticaria y entumecimiento en las palmas de las manos y en las plantas de los pies.
Artículos relacionados
-
31 Oct 2024Medicamentos con nuevos principios activos o biosimilares Medicamentos con nuevos principios activos o biosimilares
-
7 Oct 2024Medicamentos con nuevos principios activos o biosimilares Medicamentos con nuevos principios activos o biosimilares
-
6 Ago 2024Medicamentos con nuevos principios activos o biosimilares Medicamentos con nuevos principios activos o biosimilares





