Ceftobiprol medocarilo ▼ Zevtera® (Basilea) en neumonía
 Nº403
Nº403
Resumen
El ceftobiprol medocarilo es una nueva cefalosporina de amplio espectro. En realidad, se trata de un profármaco que se convierte rápidamente en la sustancia activa ceftobiprol tras su administración IV, mediante la acción de las esterasas sanguíneas. Es activa frente a una amplia gama de bacterias patógenas tanto Gram-positivas como Gram-negativas, algunas cepas productoras de betalactamasas. El medicamento ha sido autorizado para el tratamiento de neumonía extrahospitalaria e intrahospitalaria, excluyendo la neumonía asociada a ventilación mecánica. En los ensayos clínicos controlados con comparadores activos, el ceftobiprol medocarilo no fue inferior en términos de tasas de curación clínica a ceftazidima más linezolid en pacientes con neumonía adquirida en el hospital, ni a ceftriaxona ± linezolid en pacientes con neumonía adquirida en la comunidad que requiriesen hospitalización. No obstante, sí fue inferior a ceftazidima más linezolid en pacientes con neumonía adquirida en el hospital que estaban sometidos a ventilación mecánica. El ceftobiprol es generalmente bien tolerado, en línea con lo observado con otras cefalosporinas. Los eventos adversos más frecuentes relacionados con el tratamiento son náusea, diarrea, reacciones en el sitio de la infusión, vómitos, elevaciones de las enzimas hepáticas e hiponatremia. Aproximadamente un 10% de los pacientes requieren suspender prematuramente el tratamiento, debido a la incidencia de eventos adversos.
ASPECTOS FISIOPATOLÓGICOS
Las infecciones respiratorias son la causa más frecuente de consulta médica en atención primaria (10-15%) y pueden llegar a representar hasta el 60% de las urgencias hospitalarias en las que está implicado un proceso infeccioso. Se define como neumonía a la infección aguda – de gravedad variable – del parénquima pulmonar; se clasifica en 2 grandes grupos: neumonía adquirida en la comunidad (NAC) y neumonía adquirida en el hospital (NAH).
La neumonía adquirida en la comunidad (NAC) es la primera causa infecciosa de muerte y la sexta de mortalidad general en los países desarrollados. Se han notificado incidencias anuales de 5 a 11 casos por cada 1000 habitantes en estudios realizados en Europa y Estados Unidos, y hasta el 60% de estos individuos pueden necesitar tratamiento hospitalario y un 10% de los pacientes hospitalizados por NAC precisa ingreso en una unidad de cuidados intensivos (UCI). Es más frecuente en varones, en los extremos de la vida, en invierno y en presencia de factores de riesgo como el consumo de alcohol y tabaco, la malnutrición, la uremia o enfermedad pulmonar obstructiva crónica (EPOC). La mortalidad aguda se sitúa entre el 1 y el 5% en los pacientes ambulatorios, el 5,7-14% en los pacientes hospitalizados y el 34-50% en los ingresados en una UCI, especialmente en los pacientes que necesitan ventilación asistida. También la mortalidad a medio y largo plazo es elevada, con cifras del 8% a los 90 días, 21% al año y 36% a los 5 años.
La etiología infecciosa varía entre los diversos tipos de NAC, aunque en muchos casos no se llega a establecer definitivamente el agente causal (Barragán, 2016):
- Neumonía adquirida en la comunidad (NAC): Mycoplasma pneumonaie (16%), Streptococcus pneumoniae (14%), virus diversos (15%), Chlamydiophila pneumonae (12%), Legionella spp. (2%) y Heamophillus influenzae (1%)
- NAC que requiere hospitalización: Streptococcus pneumoniae (25%), virus diversos (10%), Mycoplasma pneumonaie (6%), Heamophillus influenzae (5%), Chlamydiophila pneumonae (3%), Legionella spp. (3%).
- NAC que requiere internamiento en la Unidad de Cuidados Intensivos (UCI): Streptococcus pneumoniae (17%), Legionella spp. (10%), bacilos gram negativos (5%) y Staphylococcus aureus (5%), virus diversos (4%), Heamophillus influenzae (3%).
En líneas generales, M. pneumoniae y los virus respiratorios son más prevalentes en las personas jóvenes, mientras que la neumonía aspirativa es más frecuente entre la población anciana. Por su parte, Legionella pneumophila suele afectar a adultos jóvenes y H. influenzae a pacientes con EPOC. C. pneumoniae puede presentarse tanto en jóvenes como en adultos con enfermedades de base. Zoonosis producidas por Chlamydophila psittaci y Coxiella burnetii son infrecuentes y con importantes variaciones regionales. S. aureus se observa en pacientes usuarios de drogas por vía parenteral (UDVP) con endocarditis tricuspídea, en diabéticos o como complicación de la gripe. La NAC producida por bacilos Gram negativos se asocia a estancia en centros de crónicos (Escherichia coli), etilismo (Klebsiella pneumoniae) y bronquiectasias e infección por VIH (Pseudomonas aeruginosa). Los virus de la gripe y el VRS pueden causar neumonía en adultos durante los meses fríos. Sin embargo, en la mayoría de los pacientes ambulatorios no se obtienen muestras de esputo, por lo que la etiología es desconocida en cerca de la mitad de los pacientes.
La sintomatología de la NAC es inespecífica y su diagnóstico se basa en un conjunto de signos y síntomas relacionados con una infección de vías respiratorias bajas y afectación del estado general, incluyendo fiebre (> 38 °C), tos, expectoración, dolor torácico, disnea o taquipnea y signos de ocupación del espacio alveolar. En los ancianos no es infrecuente la ausencia de fiebre y la aparición de confusión y empeoramiento de enfermedades subyacentes. En general, no existe ninguna característica, signo clínico o combinación de ellos que permita deducir una determinada etiología o diferenciar la NAC de otras infecciones de vías aéreas bajas con suficiente fiabilidad. Sin embargo, la infección por S. pneumoniae es más frecuente en pacientes de edad avanzada, con enfermedades subyacentes o con un comienzo súbito, fiebre alta y dolor torácico de características pleuríticas. Por otro lado, las bacteriemias en las NAC neumocócicas se producen con mayor frecuencia en pacientes del sexo femenino, consumidores de alcohol, pacientes con diabetes mellitus, EPOC y en aquellos que presentan tos no productiva. La NAC causada por L. pneumophila es más común en fumadores, sin comorbilidades asociadas y que presentan síntomas de diarrea, signos de infección grave y afectación neurológica multisistémica. La hiponatremia, la hipofosfatemia y la hematuria también se han relacionado con este microorganismo. Por otra parte, en la NAC causada por M. pneumoniae es poco habitual la afectación multisistémica y más común que los pacientes hayan sido tratados con antibióticos antes del diagnóstico de NAC. Las neumonías víricas están descritas con elevada frecuencia en pacientes con fallo cardiaco congestivo.
La neumonía por aspiración se produce por aspiración de material contaminado procedente del tracto digestivo o por microaspiraciones repetidas de la flora orofaríngea, en ocasiones durante el sueño. Suele ser polimicrobiana y los anaerobios y determinados estreptococos microaerofílicos desempeñan un papel preponderante. Su frecuencia se estima en alrededor del 10% de los casos de NAC. Debe sospecharse en pacientes con factores de riesgo favorecedores de aspiración, en especial trastornos de la conciencia o de la deglución, alcoholismo crónico, así como en pacientes con boca séptica.
La neumonía adquirida en el hospital (NAH) se define como aquella que se presenta a partir de las 48-72 h del ingreso hospitalario, excluyendo que la infección no estuviera presente o en periodo de incubación en el momento del ingreso. Es la segunda infección nosocomial más frecuente, después de la urinaria, y la que comporta mayor morbimortalidad. Se adquiere principalmente a través de 3 mecanismos: microaspiración de bacterias que colonizan la orofaringe y/o que están presentes en el estómago, inhalación de aerosoles y diseminación hematógena a partir de otro foco de sepsis.
Los bacilos Gram negativos (enterobacterias como K. pneumoniae, E. coli, Serratia marcescens, Enterobacter spp., y Pseudomonas aeruginosa) constituyen la etiología más frecuente (20-60%). En los enfermos sometidos a ventilación mecánica, S. aureus se sitúa en segundo lugar (10-30%), mientras que los microorganismos más prevalentes en la comunidad, como S. pneumoniae, H. influenzae o C. pneumoniae son infrecuentes. La colonización de las aguas de la mayoría de los hospitales por Legionella spp. convierte a este microorganismo en una causa endémica y relativamente frecuente de neumonía nosocomial. Cada vez se describen con mayor frecuencia neumonías nosocomiales de etiología vírica, sobre todo por VRS, influenza y parainfluenza. Hay que tener en cuenta, no obstante, las diferencias que existen en los agentes etiológicos entre los pacientes ingresados en las áreas de hospitalización general y los enfermos ventilados de las UCI, por la disparidad epidemiológica en ambos grupos de enfermos.
La neumonía es la principal complicación infecciosa en los pacientes con ventilación mecánica. La mortalidad relacionada con esta infección continúa siendo elevada, a pesar de los avances realizados en su diagnóstico y tratamiento, siendo uno de los principales factores de mal pronóstico la prescripción de antibióticos empíricos de forma inadecuada. La frecuencia de neumonías en los pacientes ventilados es muy superior a la del resto de los pacientes hospitalizados. El riesgo de adquirir una neumonía en los pacientes intubados se incrementa entre 6 y 21 veces respecto a los no intubados y aumenta entre el 1 y el 3% por cada día de ventilación mecánica.
La etiología de la neumonía adquirida en el hospital en pacientes con ventilación mecánica es polimicrobiana en el 25% de los casos. En las neumonías precoces (4-7 días de estancia en el hospital), la flora endógena primaria, formada por S. aureus, H. influenzae, S. pneumoniae y enterobacterias, es la responsable de la infección. Las neumonías tardías, en pacientes con enfermedades crónicas y que han recibido antibióticos para tratamiento o profilaxis, están producidas por flora endógena secundaria, en la que predominan P. aeruginosa, Acinetobacter baumannii y S. aureus. En general, en las neumonías tardías predominan los patógenos más prevalentes en el hospital.
En general, la vía de infección más frecuente en los pacientes ventilados es endógena, a través de la superficie externa del tubo traqueal que permite aspiraciones repetidas del exudado orofaríngeo. La vía exógena supone la colonización directa de las vías respiratorias bajas por el interior de la luz del tubo traqueal a partir de reservorios externos (respiradores, aerosoles, humidificadores), manipulaciones (aspiración de secreciones) y técnicas invasivas (broncoscopia, intubación). Esta vía ha disminuido su importancia en las últimas décadas debido a la mejor utilización de los procedimientos de esterilización y desinfección de los aparatos mecánicos. Se consideran factores de riesgo para desarrollar una neumonía todas aquellas situaciones que favorecen la aspiración de secreciones en la vía aérea, aumentan la cantidad y patogenicidad de los microorganismos inoculados y disminuyen las defensas locales del tracto respiratorio y la inmunidad sistémica. Entre ellos, destacan la duración de la ventilación mecánica, la enfermedad pulmonar crónica grave, la edad avanzada, la aspiración masiva de contenido gástrico, la reintubación o autoextubación, etc.
ACCIÓN Y MECANISMO
El ceftobiprol medocarilo es un agente antibacteriano del grupo de los betalactámicos y, concretamente, de las cefalosporinas. Actúa uniéndose a PBP (proteínas de unión a penicilinas), con función fundamentalmente de transpeptidasa y endopeptidasa, que provoca un bloqueo de los procesos de síntesis y reparación de la pared bacteriana, lo que se traduce en que la célula bacteriana puede crecer en forma de filamento o esferoblasto, con el resultado de la lisis celular al no poder mantener la presión osmótica adecuada. También se ha sugerido que este efecto podría estar relacionado con la activación de endolisinas bacterianas. Como otros antibacterianos betalactámicos, el parámetro que mejor se correlaciona con la eficacia clínica del ceftobiprol medocarilo es el porcentaje de tiempo a lo largo del día durante el que la concentración plasmática del antibiótico se mantiene por encima de la concentración mínima inhibitoria (CMI) para el patógeno causal.
El ceftobiprol tiene elevada afinidad hacia la PBP2a de cepas de Staphylococcus aureus resistentes a la meticilina (MRSA) y conserva su actividad frente a cepas que expresan homólogos de genes mecA divergentes (mecC o mecALGA251). También se une a PBP2b en Streptococcus pneumoniae, a PBP2x en Streptoccus pneumoniae resistente a la penicilina y a PBP5 en Enterococcus faecalis.
El ceftobiprol medocarilo ha demostrado actividad antimicrobiana in vitro frente a una amplia gama de bacterias patógenas tanto Gram-positivas como Gram-negativas. Entre los patógenos Gram positivos, el ha demostrado una buena actividad frente a Staphylococcus aureus resistente a la meticilina (MRSA), y estafilococos coagulasa negativos, así como contra cepas MRSA con susceptibilidad reducida a linezolid, daptomicina o vancomicina. También ha mostrado una actividad significativa frente a Streptococcus pneumoniae (incluyendo las cepas resistentes a bencilpenicilina y ceftriaxona) y Enterococcus faecalis, pero no contra Enterococcus faecium. En el caso de los patógenos Gram-negativos, el ceftobiprol ha demostrado una buena actividad frente a Haemophilus influenzae (incluidos aislados clínicos resistentes a ampicilina, Pseudomonas aeruginosa y cepas de Escherichia coli, Klebsiella pneumoniae y Proteus mirabilis no productoras de betalactamasas de amplio espectro (ESBL).
El medicamento ha sido autorizado para el tratamiento de neumonía extrahospitalaria e intrahospitalaria, excluyendo la neumonía asociada a ventilación mecánica.
El ceftobiprol medocarilo es inactivo frente a cepas de Enterobacteriaceae que expresen betalactamasas de la clase A de Amber, especialmente de tipo TEM, SHV y CTX-M, así como carbapenemasas de tipo KPC; también es inactivo frente a las clases de B, C (altos niveles de expresión) y D de Amber, particularmente las variantes BLEA y las carbapenemasas OXA-48. Asimismo, es inactivo frente a cepas de Pseudomonas aeruginosa productoras de betalactamasas de las clases A (PSE-1), B (IMP-1, VIM-1, VIM-2) y D (OXA-10). Igualmente, es inactivo frente a cepas de Acinetobacter spp. productoras de betalactamasas de las clases A (VEB-1), B (IMP-1, IMP-4) t D (OXA-25, OXA-26).
ASPECTOS MOLECULARES
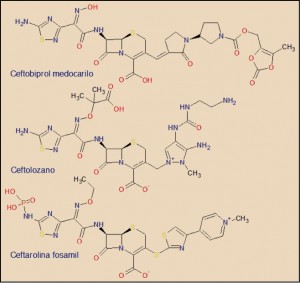
El ceftobiprol medocarilo forma parte del grupo de las cefalosporinas de 5ª generación, junto con ceftolozano y ceftarolina. Como estas últimas, está estructuralmente relacionada las otras aminotiazolilcefalosporinas (3ª y 4ª generación), especialmente cefditoreno, ceftriaxona, cefepima, cefpiroma y ceftazidima, aunque en términos estrictamente químicos, el ceftobiprol – como ceftolozano y cefatorolina fosamil – incluye un anillo de tiadiazol, un isóstero del aminotiazol. A diferencia de ceftolozano, ceftarolina, cefepima y ceftazidima, el ceftobiprol medocarilo no es una sal interna, ion bipolar o zwiterion, formada por el átomo de nitrógeno cuaternario (N+) y el grupo carboxilato (COO-). Esta característica química se relaciona con la capacidad para atravesar los canales porínicos de las bacterias Gram-negativas.
El ceftobiprol medocarilo es, en realidad, un profármaco que se convierte rápidamente en la sustancia activa ceftobiprol tras su administración IV, mediante la acción de esterasas sanguíneas de tipo A. El ceftobiprol presenta una farmacocinética lineal, tanto tras su administración de dosis únicas o múltiples de 125-1000 mg. Las concentraciones en estado estacionario se alcanzan durante el primer día de la administración (Torres, 2016).
EFICACIA Y SEGURIDAD CLÍNICAS
La eficacia y la seguridad clínicas de ceftobiprol medocarilo han sido adecuadamente contrastadas en las indicaciones autorizadas mediante dos amplios ensayos clínicos de fase 3, aleatorizados y doblemente ciegos, en pacientes con neumonía nosocomial y adquirida en la comunidad. En este sentido, el ceftobiprol no fue inferior a ceftazidima más linezolid en el tratamiento de la neumonía nosocomial ni a ceftriaxona con o sin linezolid en el tratamiento de neumonía adquirida en la comunidad.
El primero de estos ensayos clínicos (Nicholson, 2012) es un estudio multicéntrico y doble ciego, en el que 706 pacientes con neumonía adquirida en la comunidad (NAC) lo suficientemente grave como para requerir hospitalización, fueron asignados aleatoriamente a recibir un tratamiento con ceftobiprole o de ceftriaxona ± linezolid.
Los resultados clínicos y microbiológicos se determinaron 7-14 días después de la terminación del tratamiento (visita de prueba de curación). Para los 469 pacientes clínicamente evaluables (CE), las tasas de curación clínica fueron del 86,6 vs.87,4% para respectivamente (IC95% para la diferencia, -6,9 a 5,3); en el análisis por intención de tratar (ITT) de los 638 pacientes definitivamente incluidos en el estudio, las tasas de curación clínica fueron 76,4 vs. 79,3%, respectivamente (IC95% -9,3 a 3,6). Por su parte, las tasas de erradicación microbiológica en los 144 pacientes microbiológicamente evaluables (ME) fueron del 88,2 vs. 90,8% (IC95% -12,6 a 7,5). Ambos tratamientos fueron bien tolerados, con un 6% de pacientes que requirieron interrupción prematura por algún evento adverso con ceftobiprol vs. 4% con ceftriaxona ± linezolid. La incidencia global de eventos adversos relacionados con el tratamiento fue mayor en el grupo de ceftobiprol, debido principalmente a diferencias en la incidencia de náuseas (7 vs. 2%) y vómitos (5 vs. 2%).
El segundo de los ensayos clínicos (Awad, 2014) consistió en un estudio doblemente ciego, aleatorizado y multicéntrico de 781 pacientes con neumonía adquirida en el hospital (NAH), de los cuales 210 prsentaban neumonía asociada a ventilación mecánica. El tratamiento consistió en ceftobiprol por vía intravenosa 500 mg cada 8 horas, o ceftazidima 2 g cada 8 horas más linezolid 600 mg cada 12 horas. Como variable clínica principal se determinó la tasa de curación clínica
Los resultados mostraron unas tasas de curación global, por intención de tratar (ITT), del 49,9% con ceftobiprol vs. 52,8% con ceftazidima/linezolid (IC95% para la diferencia, -10,0 a 4,1); considerando exclusivamente los pacientes clínicamente evaluables (CE), dichas tasas de curación clínica fueron del 69,3 vs. 71,3%, respectivamente (IC95% -10,0 a 6,1). Excluyendo a los pacientes con neumonía asociada a ventilación mecánica, las tasas de curación clínica fueron del 59,6 vs. 58,8% (ITT; IC95% -7,3 a 8,8) y del 77,8 vs. 76,2% (CE; IC95% -6,9 a 10). Las tasas de curación clínica en los pacientes con neumonía asociada a ventilación fueron del 23,1 vs. 36,8% (ITT; IC95% -26,0 a -1,5) y del 37,7 vs. 55,9% (CE; IC95%, -36,4 a -4,0). Las tasas de erradicación microbiológica en los pacientes microbiológicamente evaluable (ME), excluyendo a los pacientes sometidos a ventilación mecánica, fueron, respectivamente, del 62,9 vs. 67,5% (IC95% -16,7 a 7,6), mientras que en pacientes con ventilación mecánica fue del 30,4 vs. 50,0% (IC95% -38,8 a -0,4). La incidencia de efectos adversos relacionados con el tratamiento en este estudio fue comparable para ceftobiprol (24,9%) y ceftazidima/linezolid (25,4%).
Globalmente, desde el punto de vista de la seguridad, el ceftobiprol medocarilo presenta un perfil toxicológico relativamente benigno, equiparable al de otras cefalosporinas, sin que se haya descrito ningún fenómeno desconocido hasta el momento. Los eventos adversos más frecuentemente (1-10%) descritos son: infección fúngica (incluyendo localizaciones vaginales, orales y cutáneas), reacciones de hipersensibilidad (urticaria, erupciones), hiponatremia, disgeusia, cefalea, mareo, somnolencia, náusea, vómitos, diarrea, dolor abdominal, incremento de los valores enzimáticos hepáticos y reacciones locales en el punto de inyección IV (dolor, induración, etc.). Aproximadamente un 10% de los pacientes requieren suspender prematuramente el tratamiento, debido a la incidencia de eventos adversos.
ASPECTOS INNOVADORES
El ceftobiprol medocarilo es una nueva cefalosporina perteneciente a la 5ª generación, junto con la ceftarolina y ceftolozano, previamente comercializadas en España. El ceftobiprol medocarilo es, en realidad, un profármaco que se convierte rápidamente en la sustancia activa ceftobiprol tras su administración IV, mediante la acción de esterasas sanguíneas de tipo A.
Es activa frente a una amplia gama de bacterias patógenas tanto Gram-positivas como Gram-negativas, incluyendo Staphylococcus aureus resistente a la meticilina (MRSA), y estafilococos coagulasa negativos, así como contra cepas MRSA con susceptibilidad reducida a linezolid, daptomicina o vancomicina. También ha mostrado una actividad significativa frente a Streptococcus pneumoniae (incluyendo las cepas resistentes a bencilpenicilina y ceftriaxona) y Enterococcus faecalis, pero no contra Enterococcus faecium. En el caso de los patógenos Gram-negativos, el ceftobiprol ha demostrado una buena actividad frente a Haemophilus influenzae (incluidos aislados clínicos resistentes a ampicilina, Pseudomonas aeruginosa y cepas de Escherichia coli, Klebsiella pneumoniae y Proteus mirabilis no productoras de betalactamasas de amplio espectro (ESBL).
El medicamento ha sido autorizado para el tratamiento de neumonía extrahospitalaria e intrahospitalaria, excluyendo la neumonía asociada a ventilación mecánica. En los ensayos de fase 3, el ceftobiprol medocarilo no fue inferior en términos de tasas de curación clínica a ceftazidima más linezolid en pacientes con neumonía adquirida en el hospital, ni a ceftriaxona ± linezolid en pacientes con neumonía adquirida en la comunidad que requiriesen hospitalización. No obstante, sí fue inferior a ceftazidima más linezolid en pacientes con neumonía adquirida en el hospital que estaban sometidos a ventilación mecánica.
El ceftobiprol es generalmente bien tolerado, en línea con lo observado con otras cefalosporinas. Los eventos adversos más frecuentes relacionados con el tratamiento son náusea, diarrea, reacciones en el sitio de la infusión, vómitos, elevaciones de las enzimas hepáticas e hiponatremia. Aproximadamente un 10% de los pacientes requieren suspender prematuramente el tratamiento, debido a la incidencia de eventos adversos.
Aunque la monoterpia con ceftobiprol medocaril puede considerarse como una opción simplificada para el tratamiento empírico inicial de los pacientes con neumonía adquirida tanto en el hospital y como en la comunidad (Syed, 2014), en ambos casos se trata de indicaciones claramente hospitalarias que requieren un enfoque personalizado, y utilizar un único antibacteriano o una combinación de dos (o más), no supone una ventaja relevante, especialmente cuando los comparadores (ceftazidima más linezolid) ha mostrado más utilidad, al cubrir a los pacientes con neumonía adquirida en el hospital sometidos a ventilación mecánica (excluidos de las indicaciones del ceftobiprol); por otro lado, las tasas de interrupción prematura de los tratamientos es algo mayor (6 vs. 4%) que con ceftriaxona ± linezolid (neumonía adquirida en la comunidad) y con una incidencia global de eventos adversos relacionados con el tratamiento fue mayor en el grupo de ceftobiprol, debido principalmente a diferencias en la incidencia de náuseas (7 vs. 2%) y vómitos (5 vs. 2%).
En definitiva, un buen agente antibacteriano que no parece aportar nada relevante al ámbito de la antibioterapia hospitalaria.
|
VALORACIÓN |
|
CEFTOBIPROL MEDOCARILO
|
|
Grupo Terapéutico (ATC): J01DI. ANTIINFECCIOSOS PARA USO SISTÉMICO. Antibacterianos. Betalactámicos: otras cefalosporinas. |
|
Indicaciones autorizadas: Tratamiento de neumonía extrahospitalaria e intrahospitalaria, excluyendo la neumonía asociada a ventilación mecánica. |
|
sin INNOVACIÓN. No implica aparentemente ninguna mejora farmacológica ni clínica en el tratamiento de las indicaciones autorizadas. |
|
FÁRMACOS RELACIONADOS REGISTRADOS EN ESPAÑA |
|||
|
Fármaco |
Medicamento® |
Laboratorio |
Año |
|
Ceftarolina fosamil |
Zinforo |
Pfizer |
2014 |
|
Ceftolozano |
Zerbaxa* |
Merck Sharp Dohme |
2016 |
|
Ceftobiprol medocarilo |
Zevtera |
Basilea |
2017 |
* Ceftolozano asociado a tazobactam.
BIBLIOGRAFÍA
Bibliografía
- Awad SS, Rodríguez AH, Chuang YC, Marjanek Z, Pareigis AJ, Reis G, et a. A phase 3 randomized double-blind comparison of ceftobiprole medocaril versus ceftazidime plus linezolid for the treatment of hospital-acquired pneumonia. Clin Infect Dis. 2014; 59(1): 51-61. doi: 10.1093/cid/ciu219.
- Barragán Prada H, Loza Fernández de Bobadilla E, Gómez García de la Pedrosa E, Tato Díez M. Infecciones del tracto respiratorio. En: Trastornos infecciosos y parasitarios. Madrid: Consejo General de Colegios Oficiales de Farmacéuticos; 2016. p. 305-40.
- Consejo General de Colegios Oficiales de Farmacéuticos. Bot PLUS WEB. https://botplusweb.portalfarma.com/
- Cuéllar Rodríguez S. Farmacología de los antibacterianos. En: Trastornos infecciosos y parasitarios. Madrid: Consejo General de Colegios Oficiales de Farmacéuticos; 2016. p. 49-120.
- Nicholson SC, Welte T, File TM Jr, Strauss RS, Michiels B, Kaul P, et al. A randomised, double-blind trial comparing ceftobiprole medocaril with ceftriaxone with or without linezolid for the treatment of patients with community-acquired pneumonia requiring hospitalisation. Int J Antimicrob Agents. 2012; 39(3): 240-6. doi: 10.1016/j.ijantimicag.2011.11.005.
- Syed YY. Ceftobiprole medocaril: a review of its use in patients with hospital- or community-acquired pneumonia. Drugs. 2014; 74(13): 1523-42. doi: 10.1007/s40265-014-0273-x.
- Torres A, Mouton JW, Pea F. Pharmacokinetics and Dosing of Ceftobiprole Medocaril for the Treatment of Hospital- and Community-Acquired Pneumonia in Different Patient Populations. Clin Pharmacokinet. 2016; 55(12): 1507-20.
Artículos relacionados
-
30 Dic 2024Medicamentos con nuevos principios activos o biosimilares Medicamentos con nuevos principios activos o biosimilares
-
2 Dic 2024Medicamentos con nuevos principios activos o biosimilares Medicamentos con nuevos principios activos o biosimilares
-
31 Oct 2024Medicamentos con nuevos principios activos o biosimilares Medicamentos con nuevos principios activos o biosimilares





