Fumarato de dimetilo TECFIDERA® (Biogen Idec)
 Nº380
Nº380
Resumen
El fumarato de dimetilo es un agente antiinflamatorio, inmunomodulador y neuroprotector, que ha sido autorizado para el tratamiento de pacientes adultos con esclerosis múltiple remitente recurrente. Desde el punto de vista de la seguridad, no parece que la toxicidad sea un problema grave, aunque la frecuencia de eventos adversos puede ser relativamente alta. Los más relevantes son sofocos, diarrea, dolor abdominal y exantema, con una incidencia ligeramente mayor que la observada con glatirámero. Se trata de una nueva opción terapéutica a considerar en el tratamiento de la forma remitente-recurrente de la esclerosis múltiple. Su mecanismo de acción es complejo y todavía no bien comprendido, aunque los datos clínicos resultan contundentes y la mejora clínica ha sido objetivamente contrastada, aunque está por ver en qué medida podría afectar a la progresión de la enfermedad.
ACCIÓN Y MECANISMO
El fumarato de dimetilo es un agente antiinflamatorio, inmunomodulador y neuroprotector, que ha sido autorizado para el tratamiento de pacientes adultos con esclerosis múltiple remitente recurrente. En realidad, se trata de un profármaco que es hidrolizado en el interior celular, dando lugar al monometiléster (fumarato ácido de metilo) y al ácido fumárico libre, aunque se desconoce en qué grado contribuye cada uno de estas sustancias a la respuesta farmacológica.
En general, el fumarato de dimetilo activa el sistema del factor nuclear eritroide-2 Nrf2, que representa una de las principales vías intracelulares protectoras frente al daño oxidativo. Las especies reactivas de oxígeno (reactive oxygen species, ROS) son radicales libres y peróxidos que presentan electrones no apareados y, por ello, son químicamente muy reactivos, siendo capaces de oxidar a numeras sustancias, tanto orgánicas como inorgánicas. Las ROS se forman espontáneamente como subproductos normales del metabolismo oxidativo y ejercen papeles decisivos en la señalización bioquímica celular. Sin embargo, cuando se generan en exceso o no son neutralizadas adecuadamente por los sistemas antioxidantes del propio organismo, pueden provocar daños sustanciales a las estructuras celulares en lo que se conoce como estrés oxidativo. De hecho, las ROS parecen estar íntimamente implicadas en la fisiopatología de la esclerosis múltiple, actuando como promotores de la migración de los leucocitos a través del endotelio vascular, responsables últimos del daño axonal y de la mielina de las vías nerviosas en la esclerosis múltiple. En este sentido, el fumarato de dimetilo ha demostrado tener un efecto protector neto sobre las neuronas y oligodendrocitos en la esclerosis múltiple (di Nuzzo, 2014).
El factor nuclear eritroide-2 o Nfr2 regula la expresión inducible de numerosos genes de enzimas destoxificantes y antioxidantes, mediante su unión a una secuencia específica del ADN (ARE, Antioxidant Response Element), que puede ser activada por diversos compuestos oxidantes y/o electofílicos. La actividad del factor Nrf2 se encuentra constitutivamente reprimida debido a su unión con un dímero de la proteína citoplásmica Keap1 (Kelch-like ECH-associated protein 1) y al citoesqueleto. Dicha unión fomenta la permanente degradación de Nrf2 por el sistema ubiquitina-proteosoma, por lo que el control primario de su función radica principalmente en su distribución subcelular, más que en la síntesis de novo. La activación de Nrf2 conduce a la inducción de genes que codifican enzimas que destruyen las ROS o que aumentan los niveles de glutatión, tales como la NAD(P)H:quinona oxidorreductasa, la tioredoxina y la hemo oxigenasa 1, todas las cuales resultan fundamentales para los mecanismos preventivos del daño oxidativo.
El fumarato de dimetilo activa la vía de Nrf2 mediante una depleción inicial de los depósitos fisiológicos de glutatión, pero sin llegar a alcanzar el límite que activaría los mecanismos celulares de apoptosis (muerte celular programada). Este mecanismo, conocido como hormesis, es similar a otros implicados en sistemas defensivos como el de tolerancia a la isquemia, a través del cual el cerebro se protege de los efectos negativos de la isquemia cerebral mediante mínimos efecto isquémicos, que permiten acondicionar el cerebro y prevenir un mayor daño neuronal.
Los astrocitos y la microglía, igualmente implicados en la cascada neuroinflamatoria de la esclerosis múltiple, son también objetivo del fumarato de dimetilo a través de la activación de la vía Nrf2 y de la inhibición del Factor Nuclear potenciador de las cadenas ligeras Kappa de las células B activadas (NF-kB). Esto último es asociado con la inducción del hemo oxigenasa-1, la activación de la síntesis de glutatión y la inhibición de la producción de citocinas proinflamatorias.
El fumarato de dimetilo inhibe la maduración de las células dendríticas y la diferenciación de los linfocitos T en las formas autorreactivas TH1 y TH17, implicadas en la respuesta inmune adaptativa que participa de forma relevante en la patogénesis de la esclerosis múltiple. En su lugar, el fármaco facilita la formación de células dendríticas de tipo II, que producen interleucina 10 (IL-10) en lugar de IL-12 e IL-23, y linfocitos TH2 (productores de IL-4) en lugar de los TH1 y TH17.
ASPECTOS MOLECULARES
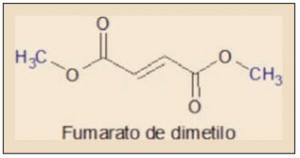
La acción farmacológica del fumarato de dimetilo (trans-1,2-etilendicarboxilato de metilo) se debe fundamentalmente a sus propiedades químicas de tipo electrofílico, siendo responsable de la activación del sistema Nfr2. En efecto, el ácido fumárico y sus ésteres constituyen un sistema α,β-insaturado – es decir, conjugado – con la reactividad característica de estas sustancias, entre las que cabe destacar las reacciones de tipo Diels-Alder, susceptibles de producir modificaciones moleculares múltiples1.
EFICACIA Y SEGURIDAD CLÍNICAS
La eficacia y la seguridad clínicas del fumarato de dimetilo en la indicación autorizada han sido contrastadas mediantes dos ensayos clínicos principales de fase III, multicéntricos, doblemente ciegos, aleatorizados y controlados con placebo (DEFINE) o con placebo y acetato de glatirámero (CONFIRM), realizados en pacientes con esclerosis múltiple remitente recurrente, utilizando dosis orales de fumarato de dimetilo de 240 mg/12 h o 240 mg/8 h, vs. placebo o acetato de glatirámero (20 mg/24 h, SC), a lo largo de 96 semanas (2 años).
El primero de estos estudios (DEFINE; Gold, 2012) se llevó a cabo sobre un conjunto de 1.234 pacientes mayores de edad (18-55 años) con diagnóstico confirmado de esclerosis múltiple remitente recurrente con un nivel basal de discapacidad de ≤5 puntos en la escala EDSS (Expanded Disability Status Scale), con al menos una recaída en los últimos doce meses y diagnóstico por imagen (RMN) positivo mostrando lesiones cerebrales congruentes con la esclerosis múltiple en los últimos seis meses. Los pacientes tenían una mediana de edad de 39 años (52% <40 años), un 74% eran mujeres y un 79% eran de raza blanca, con una mediana de peso de 68 kg. La mediana de tiempo desde los primeros síntomas de esclerosis era de 7,0 años y desde el diagnóstico de 4,0, con una mediana de 2 recaídas en los tres últimos años (al menos una de ellas en el último) y con una puntuación mediana de 2,0 en la escala EDSS. Un 55% de los pacientes habían recibido anteriormente tratamiento (interferón beta 1A, 27%; interferón beta 1B, 14%; glatirámero, 15%; natalizumab, 3%; corticosteroides, 24%; etc.).
La variable primaria de eficacia utilizada fue la proporción de pacientes que tuvieron una recaída confirmada por un comité independiente en los dos años de estudio. Como variables secundarias se determinaron las tasas anualizadas de recaídas, el tiempo medio hasta progresión confirmada de la discapacidad (al menos 1 punto en la escala EDSS durante al menos tres meses) y las variaciones experimentadas en las imágenes de RMN, particularmente de nuevas lesiones T2 hipertensas o un agrandamiento de las anteriores.
Los resultados mostraron que el porcentaje de pacientes que habían experimentado al menos un recaída en los dos años de estudios fue del 24% con 240 mg dos veces al día (cada 12 h) de fumarato de dimetilo (FDM2), 23% con FDM3 y 42% con placebo, lo que implica una reducción del riesgo del 49% con FDM2 (hazard risk, HR=0,51; IC95% 0,40 a 0,66; p<0,0001) y del 50% con FDM3 (HR=0,50; IC95% 0,39 a 0,65; p<0,0001), con respecto al placebo. Las tasas anualizadas de recaídas fueron de 0,172 (IC95% 0,138 a 0,214) con FDM2, de 0,189 (IC95% 0,153 a 0,231) con FDM3 y de 0,364 (IC95% 0,303 a 0,436) con placebo, lo que implica unas reducciones del 53% (HR=0,47; IC95% 0,37 a 0,61; p<0,0001) con FDM2 y del 48% (HR=0,52; IC95% 0,40 a 0,67; p<0,0001) con FDM3, en relación al placebo.
Asimismo, la proporción de pacientes que experimentaron progresión de la discapacidad en los dos años fueron del 16,4% con FDM2, del 17,7% con FDM3 y del 27,1% con placebo, lo que implica una reducción del riesgo de progresión del 38% (HR=0,62; IC95% 0,44 a 0,87; p=0,005) con FDM2 y del 34% (HR=0,66; IC95% 0,48 a 0,92; p=0,0128) con FDM3, con respecto al placebo. Los valores medios de nuevas lesiones (o aumento del tamaño de antiguas) determinadas por RMN fue de 2,6 con FDM2, 4,4 con FDM3 y 17,0 con placebo, lo que supone unas reducciones del 85% (HR=0,15; IC95% 0,10 a 0,23; p<0,0001) con FDM2 y del 74% (HR=0,26; IC95% 0,17 a 0,38; p<0,0001) con FDM3, en relación al placebo.
En general, los efectos favorables del tratamiento en relación al placebo fueron demostrados en cada uno los subgrupos de pacientes analizados (edad, sexo, tamaño y número de las lesiones cerebrales, etc.) comprobándose que las reducciones del riesgo de recaída oscilaron entre un 68% y un 26% con FDM2 y del 66% al 25% con FDM3 (Bar-Or, 2013). Asimismo, se registró una mejora significativa en las puntuaciones de calidad de vida, utilizando el cuestionario breve SF-36 (Kappos, 2014).
El segundo estudio (CONFIRM; Fox, 2012) comparó el fumarato de dimetilo en dos difentes psoologías (FDM2 y FDM3) con placebo y con glatirámero, aunque el estudio no fue diseñado para ensayar la superioridad o no inferioridad del fumarato de dimetilo sobre el glatirámero. Fue desarrollado en 1.417 pacientes adultos con una mediana de edad de 37 años (59% <40 años), un 70% eran mujeres y un 84% eran de raza blanca, con una mediana de peso de 69 kg. La mediana de tiempo desde los primeros síntomas de esclerosis era de 7,1 años y desde el diagnóstico de 3,0, con una mediana de 2 recaídas en los tres últimos años (al menos una de ellas en el último) y con una puntuación mediana de 2,5 en la escala EDSS. Un 55% de los pacientes habían recibido anteriormente tratamiento (interferón beta 1A, 21%; interferón beta 1B, 11%; natalizumab, 1%; corticosteroides, 15%; etc.), pero ninguna glatirámero.
La variable primaria de eficacia utilizada fue la tasa anualizadas de recaídas y como variables secundarias se determinaron las variaciones experimentadas en las imágenes de RMN, particularmente de nuevas lesiones T2 hipertensas o un agrandamiento de las anteriores, la proporción de pacientes que tuvieron una recaída confirmada en los dos años de estudio y la progresión de la discapacidad.
Los resultados mostraron que las tasas anualizadas de recaídas fueron de 0,224 (IC95% 0,179 a 0,282) con FDM2, de 0,198 (IC95% 0,156 a 0,252) con FDM3, de 0,286 (IC95% 0,232 a 0,353) con glatirámero (GLA) y de 0,401 (IC95% 0,329 a 0,488) con placebo, lo que implica unas reducciones del 44,0% (HR=0,560; IC95% 0,423 a 0,740; p<0,0001) con FDM2, del 50,5% (HR=0,495; IC95% 0,369 a 0,662; p<0,0001) con FDM3 y del 28,6% (HR=0,714; IC95% 0,548 a 0,931; p=0,0128) con GLA, en relación al placebo.
El porcentaje de pacientes que habían experimentado al menos un recaída en los dos años de estudios fue del 26% con FDM2, del 22% con FDM3, del 30% con GLA y del 39% con placebo, lo que implica una reducción del riesgo del 34,0% con FDM2 (HR=0,66; IC95% 0,51 a 0,86; p=0,002), del 44,6% con FDM3 (HR=0,55; IC95% 0,41 a 0,73; p<0,0001) y del 28,6% con GLA (HR=0,71; IC95% 0,55 a 0,92; p=0,0097), con respecto al placebo.
Por otro lado, la proporción de pacientes que experimentaron progresión de la discapacidad en los dos años fueron del 12,8% con FDM2, del 13,0% con FDM3, del 15,6% con GLA y del 16,9% con placebo, lo que implica una reducción del riesgo de progresión del 21,4% (HR=0,79; IC95% 0,52 a 1,19; p=0,2536) con FDM2, del 23,8% (HR=0,76; IC95% 0,50 a 1,16; p=0,2041) con FDM2 y del 7,3% (HR=0,93; IC95% 0,63 a 1,37; p=0,7036) con GLA, con respecto al placebo.
Los valores medios de nuevas lesiones (o aumento del tamaño de antiguas) determinadas por RMN fue de 5,7 con FDM2, 5,1 con FDM3, 5,1 con GLA y 19,9 con placebo, lo que supone unas reducciones del 71% (HR=0,29; IC95% 0,21 a 0,41; p<0,0001) con FDM2, del 73% (HR=0,27; IC95% 0,20 a 0,38; p<0,0001) con FDM3 y del 54% (HR=0,46; IC95% 0,33 a 0,63; p<0,0001) con GLA, en relación al placebo.
Como en el estudio anterior, los efectos favorables del tratamiento en relación al placebo fueron demostrados en cada uno los subgrupos de pacientes analizados (edad, sexo, tamaño y número de las lesiones cerebrales, etc.) comprobándose que las reducciones del riesgo de recaída oscilaron entre un 53% y un 34% con FDM2 y del 67% al 13% con FDM3 (Hutchinson, 2013). También se registró una mejora significativa en las puntuaciones de calidad de vida, utilizando el cuestionario breve SF-36 (Kita, 2014).
Tal como se indicó, este estudio no fue diseñado para determinar la posible superioridad o no inferioridad del fumarato de dimetilo (FDM2 y FDM3) frente a glatirámero (GLA), aunque los datos comparativos directos muestran una reducción de la tasa de anualizada de recaídas del 22% favorable a FDM2 (HR=0,78; IC95% 0,59 a 1,05; no significativa) y del 31% favorable a FDM3 (HR=0,69; IC95% 0,51 a 0,94), una reducción del número nuevas lesiones o agrandamiento de estas del 36% favorable a FDM2 (HR=0,64; IC95% 0,46 a 0,88) y del 41% favorable a FDM3 (HR=0,59; IC95% 0,43 a 0,82).
La reducción en la proporción de pacientes que recayeron fue de 8% favorable a FDM2 (HR=0,92; IC95% 0,70 a 1,22) y del 22% favorable a FDM3 (HR=0,78; IC95% 0,58 a 1,04), mientras que la reducción de la progresión de la discapacidad fue del 15% favorable a FDM2 (HR=0,85; IC95% 0,56 a 1,29) y del 18% favorable a FDM3 (HR=0,82; IC95% 0,54 a 1,26). Las diferencias entre fumarato de dimetilo y glatirámero en estas dos variables no fueron estadísticamente significativas.
Desde el punto de vista de la seguridad clínica, el perfil toxicológico del fumarato de dimetilo es amplio, aunque no parece revestir una especial gravedad en relación al placebo y al glatirámero. Los eventos adversos más frecuentemente descritos en los dos ensayos clínicos anteriores, con una diferencia de al menos 3 puntos porcentuales con respecto al placebo son: sofocos (34% FDM2, 29% FDM3, 2% GAL y 5% Placebo), diarrea (14%, 17%, 4% y 10%), náusea (12%, 14%, 5% y 9%), dolor abdominal (9%, 8%, 1% y 4%), exantema (8%, 7%, 3% y 3%) y rubefacción (7%, 7%, 1% y 2%). El porcentaje de pacientes que suspendieron el tratamiento por este motivo fue del 8% con fumarato de dimetilo, 3% con glatirámero y 4% con placebo.
ASPECTOS INNOVADORES
El fumarato de dimetilo es un agente antiinflamatorio, inmunomodulador y neuroprotector, que ha sido autorizado para el tratamiento de pacientes adultos con esclerosis múltiple remitente recurrente. Su eficacia y la seguridad clínicas han sido contrastadas mediantes dos amplios ensayos clínicos principales de fase III, multicéntricos, doblemente ciegos, aleatorizados y controlados con placebo y glatirámero, utilizando dosis orales de fumarato de dimetilo de 240 mg/12 h o 240 mg/8 h, a lo largo de dos años.
Los resultados de dichos ensayos clínicos son robustos y concluyentes, encontrándose unas tasas de reducción con respecto al placebo del 44-50% en el porcentaje de pacientes que experimentaron alguna recaída, en el 21-38% de aquellos que experimentaron progresión en la discapacidad neurológicas asociada a la esclerosis y del 71-85% en el número de nuevas lesiones neurológicas o agrandamiento de las antiguas. Esta diferencia se mantiene en todos los subgrupos analizados (sexo, edad, tamaño y número de las lesiones neurológicas, discapacidad basal, etc.).
Los datos comparativos con glatirámero muestran una tendencia a la superioridad favorable para el fumarato de dimetilo, pero las diferencias no llegaron a ser significativas estadísticamente. En cualquier caso, el estudio comparativo no fue específicamente diseñado para mostrar superioridad o no inferioridad del fumarato de dimetilo frente al glatirámero, sino frente al placebo.
Desde el punto de vista de la seguridad, no parece que la toxicidad sea un problema grave para el fumarato de dimetilo, aunque la frecuencia de eventos adversos puede ser relativamente alta. Los más relevantes son sofocos, diarrea, dolor abdominal y exantema, con una incidencia ligeramente mayor que la observada con glatirámero.
En definitiva, una nueva opción terapéutica a considerar en el tratamiento de la forma remitente-recurrente de la esclerosis múltiple (la más común). Su mecanismo de acción es complejo y todavía no bien comprendido, aunque los datos clínicos resultan contundentes y la mejora clínica ha sido objetivamente contrastada, está por ver en qué medida podría afectar a la progresión de la enfermedad. Actualmente, hay diversas opciones que dan lugar a respuestas terapéuticas significativas y que tienen una amplia experiencia clínica; por ello, se ha sugerido que en los pacientes recientemente diagnosticados los tratamientos inyectables como el interferón beta (1a y 1b) o el acetato de glatirámero irán siendo progresivamente reemplazados por los nuevos tratamientos orales, como el fumarato de dimetilo o la teriflunomida, más cómodos de manejar. No obstante, no parece que haya justificación para cambiar el tratamiento en aquellos pacientes que venían siendo tratados con los fármacos inyectables con una buena tasa de respuesta y un perfil aceptable de efectos adversos (Sorensen, 2014).
|
VALORACIÓN |
|
|---|---|
|
Fumarato de dimetilo ► TECFIDERA® (Biogen Idec) |
|
|
Grupo Terapéutico (ATC): N07XX. SISTEMA NERVIOSO. Otros fármacos. |
|
|
Indicaciones autorizadas: Tratamiento de pacientes adultos con esclerosis múltiple remitente recurrente. |
|
|
VALORACIÓN GLOBAL: INNOVACIÓN MODERADA. Aporta algunas mejoras, pero no implica cambios sustanciales en la terapéutica estándar |
♣ ♣ |
|
Novedad molecular: Mecanismo de acción innovador frente al de los tratamientos previamente disponibles para la misma indicación terapéutica. |
⇑ |
|
Novedad físico-química: Vía de administración más cómoda para el paciente. |
⇑ |
BIBLIOGRAFÍA
Bibliografía
- Bar-Or A, Gold R, Kappos L, Arnold DL, Giovannoni G, Selmaj K, et al Clinical efficacy of BG-12 (dimethyl fumarate) in patients with relapsing-remitting multiple sclerosis: subgroup analyses of the DEFINE study. J Neurol. 2013; 260(9): 2297-305.
- Consejo General de Colegios Oficiales de Farmacéuticos. Bot PLUS WEB. https://botplusweb.portalfarma.com/
- di Nuzzo L, Orlando R, Nasca C, Nicoletti F. Molecular pharmacodynamics of new oral drugs used in the treatment of multiple sclerosis. Drug Des Devel Ther. 2014; 8: 555-68. doi: 10.2147/DDDT.S52428.
- European Medicines Agency (EMA). Tecfidera®. European Public Assessment Report (EPAR). EMA/204830/2013; EMEA/H/C/002601. http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_-_Public_assessment_report/human/002601/WC500162070.pdf
- Fox RJ, Miller DH, Phillips JT, Hutchinson M, Havrdova E, Kita M, et al; CONFIRM Study Investigators. Placebo-controlled phase 3 study of oral BG-12 or glatiramer in multiple sclerosis. N Engl J Med. 2012; 367(12): 1087-97.
- Gold R, Kappos L, Arnold DL, Bar-Or A, Giovannoni G, Selmaj K, et al; DEFINE Study Investigators. Placebo-controlled phase 3 study of oral BG-12 for relapsing multiple sclerosis. N Engl J Med. 2012; 367(12): 1098-107.
- Hutchinson M, Fox RJ, Miller DH, Phillips JT, Kita M, Havrdova E, et al. Clinical efficacy of BG-12 (dimethyl fumarate) in patients with relapsing-remitting multiple sclerosis: subgroup analyses of the CONFIRM study. J Neurol. 2013; 260(9): 2286-96. doi: 10.1007/s00415-013-6968-1.
- Kappos L, Gold R, Arnold DL, Bar-Or A, Giovannoni G, Selmaj K, et al. Quality of life outcomes with BG-12 (dimethyl fumarate) in patients with relapsing-remitting multiple sclerosis: the DEFINE study. Mult Scler. 2014; 20(2): 243-52. doi: 10.1177/1352458513507817.
- Kita M, Fox RJ, Phillips JT, Hutchinson M, Havrdova E, Sarda SP, et al. Effects of BG-12 (dimethyl fumarate) on health-related quality of life in patients with relapsing-remitting multiple sclerosis: findings from the CONFIRM study. Mult Scler. 2014; 20(2): 253-7. doi: 10.1177/1352458513507818.
- Sorensen PS. New management algorithms in multiple sclerosis. Curr Opin Neurol. 2014; 27(3): 246-59. doi: 10.1097/WCO.0000000000000096.
1 Este tipo de reacciones se lleva a cabo entre un dieno conjugado (un sistema de 4 electrones π) y un compuesto con un doble enlace (un sistema con 2 electrones π), formándose un dos nuevos enlaces σ a expensas de los dos enlaces π del dieno y del dienófilo.
Artículos relacionados
-
2 Abr 2025Medicamentos con nuevos principios activos o biosimilares Medicamentos con nuevos principios activos o biosimilares
-
27 Feb 2025Medicamentos con nuevos principios activos o biosimilares Medicamentos con nuevos principios activos o biosimilares
-
30 Dic 2024Medicamentos con nuevos principios activos o biosimilares Medicamentos con nuevos principios activos o biosimilares




