Nintedanib OFEV® (Boehringer Ingelheim)
 Nº390
Nº390
Resumen
Nintedanib es un inhibidor de diversas tirosina cinasas, autorizado como medicamento huérfano para el tratamiento en adultos de la fibrosis pulmonar idiopática. Actúa fundamentalmente sobre tirosina cinasas acopladas a los receptores de los factores de crecimiento derivados de plaquetas α y β (PDGFR α y β), los del factor del crecimiento de fibroblastos 1, 2 y 3 (FGFR 1-3), y los del factor del crecimiento del endotelio vascular 1, 2 y 3 (VEGFR 1-3), lo que impide la activación de sus respectivas cascadas de señalización bioquímica intracelular, que están íntimamente implicadas en los procesos de proliferación, migración y diferenciación de los fibroblastos en miofibroblastos pulmonares en los pacientes con fibrosis pulmonar idiopática. Nintedanib supone una nueva aportación en este ámbito, con un perfil farmacológico mejor conocido – pero aparentemente diferente – que el de la pirfenidona, lo que amplía las opciones terapéuticas en esta indicación.
FIBROSIS PULMONAR IDIOPÁTICA
Se trata de una enfermedad crónica, progresiva y mortal, de carácter fibrosante, que se caracteriza por una disminución de la función pulmonar. Está limitada al pulmón y afecta generalmente a adultos mayores de 50 años; es de origen desconocido (idiopático). El término fibrosis alude a la formación de un tejido cicatricial que sustituye al parénquima pulmonar normal y que, en última instancia, es responsable del agravamiento irreversible de la disnea, la cual tiene múltiples y fatales consecuencias.
La fibrosis pulmonar idiopática está integrada en el grupo de las neumonías intersticiales idiopáticas, formado por más de 200 enfermedades cuya característica en común es la afectación principal del intersticio pulmonar, el tejido que mantiene ligados a los alveolos. No obstante, en las neumonías intersticiales – y dentro de ellas, a la fibrosis pulmonar idiopática – no solo está afectado el intersticio pulmonar, sino que es frecuente que lo esté el propio alveolo, las vías respiratorias e incluso los vasos sanguíneos del árbol respiratorio. En este sentido, el tejido pulmonar de los pacientes con fibrosis pulmonar idiopática muestra un patrón histopatológico característico de neumonía intersticial usual (NIU). Se estima que la incidencia varía entre 4,6 y 7,4/100.000 habitantes, mientras que la prevalencia se sitúa entre 13/100.000 habitantes en mujeres y 20/100.000 habitantes en varones, lo que implica que se trata de una enfermedad rara. Aproximadamente, se registran al año unos 35.000 nuevos casos en la Unión Europea y en España afecta a unas 7.500 personas (Cuéllar, 2014).
El proceso fibrótico crónico en la fibrosis pulmonar idiopática conduce a unos pulmones encogidos, densos y firmes, semejando un panal de abejas, que es lo que determina el progresivo desarrollo de disnea y el empeoramiento de la función respiratoria, hasta desembocar en la muerte del paciente. Sus manifestaciones clínicas más comunes consisten en tos no productiva, disnea asociada a esfuerzo físico (de carácter progresivo), sonidos respiratorios crepitantes en la inspiración, acropaquia (dedos en forma de baqueta o palillo de tambor) y resultados anormales en las pruebas funcionales pulmonares, que indican restricción y deterioro del intercambio de gases. Según los criterios funcionales, se considera una fibrosis pulmonar idiopática leve a moderada cuando la capacidad vital forzada es de al menos un 50% de los valores teóricos, una capacidad de difusión del monóxido de carbono (DLCO) de al menos un 35% y una distancia recorrida andando en seis minutos (prueba de marcha de los 6 minutos, PM6M; 6 minute walking test, 6MWT) de al menos 150 metros.
La evolución del proceso es variable y poco predecible en el momento del diagnóstico; aunque algunos pacientes pueden permanecer asintomáticos durante 2-3 años, la mayoría presenta una lenta progresión con deterioro clínico y funcional que finalmente ocasiona insuficiencia respiratoria crónica. En otros casos existen periodos de relativa estabilidad con episodios de agudización (exacerbaciones agudas u otras complicaciones) que son causa de una alta morbimortalidad. En una minoría de pacientes la enfermedad es de corta duración, con una progresión más rápida (forma acelerada). En general la supervivencia media es de 2-5 años desde el inicio de los síntomas, lo que viene a suponer que la supervivencia a 5 años tras el diagnóstico de la enfermedad se estima entre el 20 y el 40 %.
La etiología de la fibrosis pulmonar idiopática se desconoce por el momento; probablemente es multifactorial, aunque hay sujetos con una cierta predisposición genética. Posiblemente es la consecuencia final de un proceso anómalo de cicatrización, por el que se produce una acumulación local de colágeno en el tejido intersticial, así como un cuadro inflamatorio aunque no muy intenso.
La lesión inicial o acumulada parece afectar específicamente los epiteliocitos alveolares (EA) normales (de tipo I) que recubren la superficie alveolar. Cuando estas células se dañan o desaparecen, son sustituidos por epiteliocitos de tipo II que proliferan para recubrir las zonas expuestas del alveolo; en condiciones normales, la mayoría de los EA de tipo II acaban desapareciendo y los restantes se transforman en EA de tipo I, normalizándose el tejido. Sin embargo, en los cuadros patológicos y en presencia del factor de crecimiento transformante beta (TGFβ), los fibroblastos se acumulan en estas zonas de daño y se diferencian en miofibroblastos que segregan colágeno y otras proteínas.
Las alteraciones genéticas más frecuentemente relacionadas con la fibrosis pulmonar idiopática se refieren a mutaciones en los genes que codifican la telomerasa, la cual mantiene la longitud de los telómeros (TERT, TERC; mutaciones que son más frecuentes en las formas familiares), así como en la proteína C del surfactante y en la región promotora de la mucina 5 B (MUC5B). Pese a ello, no existe ninguna prueba genética de referencia para valorar la predisposición a padecer la enfermedad. Adicionalmente, el tabaquismo y la exposición a sílice, latón, acero, plomo y polvo de madera, así como las actividades laborales en ganadería y en agricultura, y la construcción de casas de madera son considerados factores de riesgo. Asimismo, hay estudios que demuestran que el reflujo gastroesofágico es un factor de riesgo para la predisposición y la progresión de la enfermedad. Por último, se ha sugerido un posible origen autoinmune de la fibrosis pulmonar idiopática, atendiendo a ciertas similitudes radiológicas e histológicas con varias enfermedades del tejido conectivo.
Los factores asociados a peor evolución son una edad superior a 70 años, comorbilidades asociadas como la hipertensión pulmonar, el enfisema y el carcinoma broncogénico; el grado de disnea basal y su incremento en el tiempo; capacidad de transferencia pulmonar de monóxido de carbono (DLCO) menor del 40% (porcentaje del valor predicho) en el momento del diagnóstico; descenso ≥10% de la capacidad vital forzada (CVF) y ≥15% de la DLCO en 6-12 meses; y grado de desaturación en la prueba de la marcha de los 6 minutos (PM6M). En este último aspecto, cabe indicar que tanto la saturación arterial periférica de oxígeno (SpO2) ≤88% como la distancia recorrida son predictores de la mortalidad; en este sentido, la reducción en las últimas 24 semanas de más de 50 m en la distancia recorrida se asocia a un aumento de cuatro veces el riesgo de muerte en un año. También se ha identificado la importancia de la recuperación de la frecuencia cardíaca tras la prueba: el descenso menor de 14 latidos tras el primer minuto es un factor independiente de mal pronóstico; y la extensión de la fibrosis y progresión de la misma. Aunque se han señalado a algunos biomarcadores para evaluar la evolución de la enfermedad en los pacientes, aún no han sido suficientemente validados.
Frecuentemente, los pacientes con fibrosis pulmonar idiopática desarrollan complicaciones y comorbilidades. La más característica es la exacerbación, definida como el rápido deterioro de la enfermedad en ausencia de infección, insuficiencia cardiaca, embolismo pulmonar u otra causa identificable. Su incidencia y su mortalidad varían, con incidencia a un año del 9-14% y a 3 años del 21-24%, y mortalidad de hasta el 60-70% en 3-6 meses.
La prevalencia de hipertensión pulmonar en la fibrosis pulmonar idiopática se estima en un 30-45% en pacientes evaluados para trasplante pulmonar, pero es mucho mayor en aquellos con más tiempo de evolución de la enfermedad y en el momento del trasplante. El desarrollo de hipertensión pulmonar empeora la calidad de vida y la situación funcional de estos pacientes; además se asocia a una menor supervivencia. El enfisema pulmonar tiene una prevalencia es del 30-50% en estos pacientes y suele aparecer en varones con antecedentes de tabaquismo y disnea importante. Asimismo, se ha documentado ampliamente la alta prevalencia (66-90%) del reflujo gastroesofágico en pacientes con fibrosis pulmonar idiopática, aunque es asintomático en gran parte de ellos. También tienen una elevada prevalencia de síndrome de apnea-hipopnea del sueño (SAHS) y otros trastornos respiratorios durante el sueño. Finalmente, existe mayor riesgo de desarrollar carcinoma broncogénico, con prevalencia es del 5-10% que aumenta con el tiempo de evolución de la enfermedad y en los pacientes con enfisema. En los pacientes con fibrosis pulmonar idiopática también se encuentra aumentado el riesgo de enfermedades cardiovasculares (enfermedad coronaria y enfermedad tromboembólica venosa) y el neumotórax puede ser causa de empeoramiento de la fibrosis, siendo su incidencia superior al 10%.
Como norma general, deben evitarse o tratarse las causas agravantes o factores asociados de la enfermedad (reflujo gastroesofágico, infecciones respiratorias, hipertensión, tabaquismo), tratar los síntomas, principalmente la tos y la disnea, y llegado el caso, trasplante pulmonar.
Hasta la autorización de la pirfenidona, no existía hasta el momento ningún tratamiento indicado específicamente para la fibrosis pulmonar idiopática y ninguno de los medicamentos utilizados hasta el momento (corticosteroides, azatioprina, anticoagulantes, bosentán, colchicina, ciclosporina, interferón gamma, etanercept, etc.) han demostrado grado alguno de utilidad o actividad sobre la progresión de la enfermedad, por lo que su uso crónico no está recomendado. El mucolítico acetilcisteína (NAC, N-acetilcisteína) en inhalación ha sido estudiado en varios ensayos clínicos controlados con placebo y aunque parece estabilizar la capacidad vital forzada en pacientes con formas iniciales de fibrosis pulmonar idiopática, un estudio reciente (Martínez, 2014) ha demostrado que, en combinación con prednisona y azatioprina, incrementa la mortalidad y la tasa de hospitalización entre estos pacientes.
Afortunadamente, la investigación y desarrollo de agentes antifibrosantes está comenzando a dar un cierto giro al tratamiento farmacológico de la fibrosis pulmonar idiopática. En este sentido, la pirfenidona fue el primer medicamentos autorizado específicamente en esta indicación; se trata de un fármaco con propiedades antiinflamatorias y antifibróticas, que inhibe la proliferación fibroblástica y la síntesis de proteínas fibrogénicas y de citocinas proinflamatorias (Cuéllar, 2014). Por su parte, el nintedanib, un potente inhibidor de la tirosina cinasa que actúa sobre los receptores de factores de crecimiento endotelial vascular (VEGF), plaquetario (PDGF) y fibroblástico (FGF), se acaba de incorporar a las opciones disponibles para el tratamiento de la fibrosis pulmonar idiopática. En cualquier caso, son numerosas las opciones experimentales consideradas como posibles antifibróticos, aunque algunos autores consideran que, posiblemente, el futuro la terapéutica de la fibrosis pulmonar idiopática pasará por la asociación de fármacos que actúen de forma sinérgica sobre diferentes vías patogénicas de la enfermedad.
El trasplante de pulmón puede resultar apropiado para pacientes físicamente aptos (menores de 65 años y sin sobrepeso) para soportar una intervención de estas características, prefiriéndose el trasplante bilateral sobre el simple. El trasplante de pulmón ha demostrado reducir el riesgo de muerte en un 75 % en comparación con los pacientes que permanecen en la lista de espera y las tasas de supervivencia a los cinco años después de un trasplante de pulmón superan el 50%.
ACCIÓN Y MECANISMO
Nintedanib es un inhibidor de diversas tirosina cinasas, incluyendo aquellas acopladas a los receptores de los factores de crecimiento derivados de plaquetas (PDGFR) α y β, los del factor del crecimiento de fibroblastos (FGFR) 1, 2 y 3, y los del factor del crecimiento del endotelio vascular (VEGFR) 1, 2 y 3. Esto impide la activación de las cascadas de señalización bioquímica intracelular de los FGFR y PDGFR, íntimamente implicados en los procesos de proliferación, migración y diferenciación de los fibroblastos en miofibroblastos pulmonares en los pacientes con fibrosis pulmonar idiopática. El medicamento ha sido autorizado para el tratamiento en adultos de la fibrosis pulmonar idiopática.
El fármaco ha demostrado ejercer efectos no solo preventivos sino también terapéuticos; es decir, actúa incluso cuando la lesión fibrótica ya ha comenzado a desarrollarse. En estudios en animales de experimentación, el nintedanib ha demostrado reducir la fibrosis pulmonar inducida por bleomicina y por sílice. Por otro lado, inhibe la proliferación celular estimulada por PDGF, FGF y VEGF de fibroblastos pulmonares humanos procedentes de pacientes con fibrosis pulmonar idiopática, a concentraciones (EC50) de 11, 5,5 y <1 nmol/L, respectivamente; asimismo, a concentraciones entre 100 y 1000 nmol/L inhibe la migración de dichas células y la transformación en miofibroblastos inducida por TGF-β2 (factor de crecimiento transformante beta 2).
A nivel mecanístico, la acción del nintedanib sobre los tirosina cinasas acopladas a los receptores de los factores de crecimiento mencionados se produce por un proceso competitivo con el ATP en el punto de unión de éste con el receptor, impidiendo de esta forma el aporte energético requerido para la activación del receptor. Además de las cinasas acopladas a los receptores de los factores de crecimiento mencionados, el nintedanib inhibe también a otras tirosina cinasas: Flt-3, Lck y Src. Carece prácticamente de actividad sobre las cinasas del receptor de insulina (InsR), factor de crecimiento epidérmico (EGFR), HER2 y CDK(1-4).
ASPECTOS MOLECULARES
El nintedanib fue diseñado por los laboratorios Boehringer Ingelheim específicamente para inhibir determinados receptores de factores de crecimiento implicados en procesos de proliferación y diferenciación celular. En concreto, mostró un elevado poder antiangiogénico, que le hacía muy apropiado como agente citotóxico en diferentes tipos de cáncer, particularmente gastrointestinales, ginecológicos, de mama y de pulmón (no microcítico). Asimismo, atendiendo a la estrecha implicación de los receptores de los factores de crecimiento de plaquetas (PDGFR), los de fibroblastos (FGFR) y los del endotelio vascular (VEGFR) en la patogenia de la fibrosis pulmonar idiopática, se orientó al fármaco también hacia esta indicación, dado su perfil bioquímico.
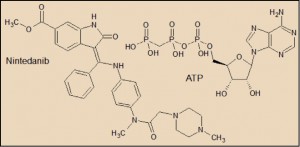
Estructuralmente, el nintedanib recuerda al ATP (adonosina trifosfato) y, de hecho, es capaz de suplantar a esta molécula en las zonas de unión de determinadas cinasas, impidiendo el acceso del ATP y, con ello, privando a dichos receptores del suministro energético preciso para el inicio de la activación de señalización bioquímica en el interior celular. Por otro lado, el agrupamiento acetilo (CH3OOC-) del sistema anular indolónico parece ser determinante en la selectividad específica hacia el hueco del ATP de las cinasas de PDGFR, FGFR y VEGFR.
EFICACIA Y SEGURIDAD CLÍNICAS
La eficacia y la seguridad clínicas del nintedanib han sido adecuadamente contrastadas en las indicaciones autorizadas mediante dos ensayos clínicos de fase 3 (confirmatorios de eficacia y seguridad) con idéntico diseño, aleatorizados, multicéntricos, multinacionales, doblemente ciegos y controlados con placebo.
Los pacientes incluidos en dichos ensayos clínicos había sido diagnosticados de fibrosis pulmonar idiopática – confirmada mediante biopsia – menos de cinco años antes, tenían ≥40 años, una capacidad de difusión del monóxido de carbono (DLCO) de entre 30% y 79% de la predicha y una capacidad vital forzada (CVF; volumen máximo de aire que el sujeto es capaz de inspirar y espirar haciendo el máximo esfuerzo posible) ≥50% del predicho. Esto supone que los pacientes incluidos presentaban una fibrosis leve a moderada, ya que, según los criterios funcionales, se considera esta categoría cuando la CVF es de al menos un 50% de los valores teóricos, la DLCO de al menos un 35% y una distancia recorrida andando en seis minutos (prueba de marcha de los 6 minutos, PM6M; 6 minute walking test, 6MWT) de al menos 150 metros.
La variable primaria de eficacia utilizada en ambos estudios fue la tasa anual de reducción de la capacidad vital forzada (CVF). Como variables secundarias se determinó la variación anual (media) de la puntuación con la escala SGRQ (St. George’s Respiratory Questionnaire1), el porcentaje de pacientes con alguna exacerbación, la variación (media) en puntos porcentuales de la CVF y la variación absoluta en la capacidad de difusión del monóxido de carbono (DLCO), expresada en mmol/min/KPa. Los estudios tuvieron una duración de 52 semanas (un año), utilizándose dosis de 150 mg/12 h, por vía oral, seleccionadas a partir del estudio de fase 2 (Richeldi, 2011) en función de su eficacia y seguridad.
Las características y resultados de los ensayos clínicos con nintedanib controlados con placebo están recopilados en la tabla 1, en la que se ha incluido – a título exclusivamente ilustrativo – un estudio de similares características e indicaciones realizados con pirfenidona (King, 2014).
|
Tabla 1. Estudios clínicos de fase 3 con nintedanib controlados con placebo |
|||
|
Indicación estudiada |
Fibrosis pulmonar idiopática leve a moderada |
||
|
Tratamientos comparados |
Nintedanib 150 mg/12 h, oral Placebo, oral |
Nintedanib 150 mg/12 h, oral Placebo, oral |
Pirfenidona 801 mg/8 h, oral Placebo, oral |
|
Pacientes aleatorizados |
513 |
548 |
555 |
|
Duración estudio |
52 semanas |
52 semanas |
52 semanas |
|
Edad (mediana) |
68,0 años |
67,0 años |
68,0 años |
|
Sexo (varones) |
81% |
78% |
79% |
|
Raza (blancos) |
65% |
50% |
69% |
|
Índice de masa corporal (IMC; mediana) |
28,4 kg/m2 |
27,4 kg/m2 |
- |
|
Antigüedad del diagnóstico (mediana) |
1,6 años |
1,6 años |
1,7 años |
|
Exfumadores/fumadores actuales |
76% |
68% |
64% |
|
CVF basal (% de la teórica; mediana) |
80% |
79% |
68% |
|
CVF basal absoluta (media) |
2801 ml |
2646 ml |
- |
|
DLCO basal (% de la teórica; mediana) |
- |
- |
44% |
|
DLCO basal absoluto; media) |
3,96 mmol/min/KPa |
3,76 mmol/min/KPa |
- |
|
Puntuación SGRQ basal (media) |
39,7 |
39,4 |
- |
|
6MWT basal (mediana) |
- |
- |
418 m |
|
Determinación de la variable primaria |
52 semanas |
52 semanas |
52 semanas |
|
Tasa anual de variación absoluta de la CVF |
Nintedanib: -115 ml Placebo: -240 ml |
Nintedanib: -114 ml Placebo: -219 ml |
|
|
% pacientes con ≥10% reducción de la CVF o muerte |
Pirfenidona: 16,5% Placebo: 31,8% |
||
|
Variación anual CVF (media; puntos porcentuales, pp) |
Nintedanib: -2,8 pp Placebo: -6,0 pp |
Nintedanib: -3,1 pp Placebo: -6,2 pp |
|
|
Variación anual de la puntuación SGRQ (media) |
Nintedanib: +4,34 Placebo (ns): +4,39 |
Nintedanib: +2,80 Placebo: +5,48 |
|
|
Variación anual absoluta DLCO |
Nintedanib: -0,38 mmol/min/KPa Placebo (ns): -0,37 mmol/min/KPa |
Nintedanib: -0,29 mmol/min/KPa Placebo (ns): -0,40 mmol/min/KPa |
|
|
% pacientes sin reducción de la CVF |
Pirfenidona: 22,7% Placebo: 9,7% |
||
|
% pacientes con exacerbaciones pulmonares |
Nintedanib: 6,1% Placebo (ns): 5,4% |
Nintedanib: 3,6% Placebo: 9,6% |
|
|
% pacientes con ≥50 m reducción de la 6MWT o muerte |
Pirfenidona: 25,9% Placebo: 35,7% |
||
|
Referencia |
INPULSIS-1 (Richeldi, 2014) |
INPULSIS-2 (Richeldi, 2014) |
ASCEND (King, 2014) |
Nota: Todas las diferencias en las variables observadas con los datos del medicamento de referencia y los del placebo fueron estadísticamente significativas, salvo aquellas notadas con (ns).
Desde el punto de vista de la seguridad, el nintedanib presenta un perfil toxicológico importante, con frecuentes eventos adversos aunque mayoritariamente leves o moderados, transitorios y tratables fácilmente. Son particularmente frecuentes (>10%) los trastornos gastrointestinales, especialmente diarrea, náusea y vómitos, así como las elevaciones de los valores analíticos de los enzimas hepáticos, que puede sugerir un cierto potencial hepatotóxico.
La incidencia eventos adversos relacionados con el tratamiento fue del 71% con nintedanib vs. 28% con placebo, siendo la de eventos adversos graves del 27 vs. 23%; un 19 vs. 13% suspendieron el tratamiento por este motivo.
En concreto, los eventos adversos más comunes fueron (EMA, 2014): diarrea (62 vs. 18%), náusea (25 vs. 6,6%), vómitos (12 vs. 2,6%), dolor abdominal (12 vs. 2,4%), reducción del apetito (11 vs. 5,7%), hipertensión sistólica (9,6 vs. 6,6%), dolor epigástrico (6,4 vs. 3,5%) y estreñimiento (6,0 vs. 4,0%). Se registraron incrementos de los valores analíticos de los enzimas hepáticos: GGT (39 vs. 10%), ALT (27 vs. 7,2%), AST (21 vs. 5,3%), fosfatasa alcalina (15 vs. 6,8%) y bilirrubina total (7,7 vs. 5,3%), aunque en ningún paciente se observó la elevación conjunta de ALT o AST por encima de tres veces los valores fisiológicos normales y de bilirrubina total por encima de dos veces los límites fisiológicos.
ASPECTOS INNOVADORES
Nintedanib es un inhibidor de diversas tirosina cinasas que ha sido autorizado como medicamento huérfano para el tratamiento en adultos de la fibrosis pulmonar idiopática. Actúa fundamentalmente sobre tirosina cinasas acopladas a los receptores de los factores de crecimiento derivados de plaquetas α y β (PDGFR α y β), los del factor del crecimiento de fibroblastos 1, 2 y 3 (FGFR 1-3), y los del factor del crecimiento del endotelio vascular 1, 2 y 3 (VEGFR 1-3), lo que impide la activación de sus respectivas cascadas de señalización bioquímica intracelular, que están íntimamente implicadas en los procesos de proliferación, migración y diferenciación de los fibroblastos en miofibroblastos pulmonares en los pacientes con fibrosis pulmonar idiopática.
La autorización oficial del nintedanib se ha basado principalmente en dos ensayos clínicos de fase 3, que han evidenciado adecuadamente una reducción de la declinación de la función pulmonar de los pacientes. En concreto, se ha observado una diferencia de 125 (240 vs. 115) ml y 94 (219 vs. 114) ml vs. placebo, entre los valores absolutos basales y los registrados al final del tratamiento (un año) de la capacidad vital forzada (CVF). Aunque este parámetro clínico es adecuado como variable primaria, quizá no es la idónea ya que sería preferible expresar la evolución de la función pulmonar en términos de variación de la CVF teórica o predicha, a fin de limitar posibles sesgos demográficos (EMA, 2014). En cualquier caso – como se aprecia en la Tabla 1 – hay un claro paralelismo entre ambos tipos de datos.
No obstante, el resto de variables clínicos no resultan concluyentes, ya que existen datos discordantes entre los dos ensayos pivotales – a pesar de tener un diseño metodológico prácticamente idéntico – como los de calidad de vida (puntuación de la escala SGRQ) o el porcentaje de pacientes que han experimentado exacerbaciones durante el periodo estudiado. Aún más, en ninguno de los dos estudios se aprecian diferencias estadísticamente significativas vs. placebo con relación a la variación de la capacidad de difusión del monóxido de carbono (DLCO).
El nintedanib es un medicamento con un perfil toxicológico relevante, con frecuentes eventos adversos aunque mayoritariamente leves o moderados, transitorios y tratables fácilmente. Son particularmente frecuentes los trastornos gastrointestinales, especialmente diarrea, náusea y vómitos, así como las elevaciones de los valores analíticos de los enzimas hepáticos, que puede sugerir un cierto potencial hepatotóxico.
La fibrosis pulmonar idiopática es una enfermedad grave, con un pronóstico muy malo, por lo que cualquier nueva opción terapéutica que aparezca es siempre bienvenida, particularmente si es capaz de actuar frenando el curso evolutivo de incapacitación pulmonar de la enfermedad; sin embargo, es evidente que, aunque clínicamente útil, el nintedanib tiene un efecto modesto. En este sentido, se trata del segundo medicamento en recibir la autorización para esta indicación, tras la pirfenidona (Esbriet®).
No es fácil hacer una valoración comparada de ambos medicamentos, dado que no se dispone de un estudio clínico directamente comparativo y, tal como se manifiesta en la tabla 1, se aprecian algunas diferencias entre los ensayos clínicos pivotales, particularmente en lo que se refiere a los criterios clínicos y antropométricos de inclusión para los pacientes, así como en las variables clínicas utilizadas (Mylläniemi, 2015). Por otro lado, la pirfenidona se ha asociado con un notable y estadísticamente significativo descenso del 48% (3,5 vs. 6,7%) del riesgo de muerte – durante un año de tratamiento – por cualquier causa, que alcanza el 68% (1,1 vs. 3,5%) en la muerte relacionada con la fibrosis pulmonar (Cuéllar, 2014), algo que está por demostrar con el nintedanib.
Sea como fuere, nintedanib supone una nueva aportación en este ámbito, con un perfil farmacológico mejor conocido – pero aparentemente diferente – que el de la pirfenidona, lo que amplía las opciones terapéuticas en esta indicación.
|
VALORACIÓN |
|
|
NINTEDANIB
|
|
|
Grupo Terapéutico (ATC): L01XE. TERAPIA ANTINEOPLÁSICAS Y AGENTES INMUNOMODULADORES. Citostáticos: inhibidores directos de la tirosina cinasa. |
|
|
Indicaciones autorizadas: Tratamiento de la fibrosis pulmonar idiopática en adultos. |
|
|
VALORACIÓN GLOBAL: INNOVACIÓN MODERADA. Aporta algunas mejoras, pero no implica cambios sustanciales en la terapéutica estándar. |
♣ ♣ ♣ |
|
Novedad clínica: Mejora la eficacia clínica con relación al tratamiento estándar. |
⇑ |
|
Novedad molecular: Mecanismo de acción innovador frente al de los tratamientos previamente disponibles para la misma o similar indicación terapéutica. |
⇑ |
|
FÁRMACOS RELACIONADOS REGISTRADOS EN ESPAÑA |
|||
|
Fármaco |
Medicamento® |
Laboratorio |
Año |
|
Pirfenidona |
Esbriet |
InterMune |
2014 |
|
Nintedanib |
Ofev |
Boehringer Ingelheim |
2015 |
BIBLIOGRAFÍA
Bibliografía
- Consejo General de Colegios Oficiales de Farmacéuticos. Bot PLUS WEB. https://botplusweb.portalfarma.com/
- Cuéllar Rodríguez S. Pirfenidona (Esbriet®) en fibrosis pulmonar idiopática. Panorama Actual Med 2014; 38(376): 741-5.
- European Medicines Agency (EMA). Ofev®.European Public Assessment Report (EPAR). EMA/724832/2014; EMEA/H/C/003821. http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_-_Public_assessment_report/human/003821/WC500182476.pdf
- King TE Jr, Bradford WZ, Castro-Bernardini S, Fagan EA, Glaspole I, Glassberg MK, Gorina E, Hopkins PM, Kardatzke D, Lancaster L, Lederer DJ, Nathan SD, Pereira CA, Sahn SA, Sussman R, Swigris JJ, Noble PW; ASCEND Study Group.A phase 3 trial of pirfenidone in patients with idiopathic pulmonary fibrosis. N Engl J Med. 2014; 370(22): 2083-92. doi: 10.1056/NEJMoa1402582.
- Martinez FJ, de Andrade JA, Anstrom KJ, King TE Jr, Raghu G; Idiopathic Pulmonary Fibrosis Clinical Research Network. Randomized trial of acetylcysteine in idiopathic pulmonary fibrosis. N Engl J Med. 2014; 370(22): 2093-101.doi: 10.1056/NEJMoa1401739.
- Myllärniemi M, Kaarteenaho R.Pharmacological treatment of idiopathic pulmonary fibrosis – preclinical and clinical studies of pirfenidone, nintedanib, and N-acetylcysteine. Eur Clin Respir J. 2015 Feb 10; 2. doi: 10.3402/ecrj.v2.26385.
- Richeldi L, du Bois RM, Raghu G, Azuma A, Brown KK, Costabel U, et al; INPULSIS Trial Investigators.Efficacy and safety of nintedanib in idiopathic pulmonary fibrosis. N Engl J Med. 2014; 370(22): 2071-82. doi: 10.1056/NEJMoa1402584.
- Richeldi L, Costabel U, Selman M, Kim DS, Hansell DM, Nicholson AG, et al. Efficacy of a tyrosine kinase inhibitor in idiopathic pulmonary fibrosis. N Engl J Med. 2011; 365(12): 1079-87. doi: 10.1056/NEJMoa1103690.
1 El cuestionario respiratorio St. George (SGRQ) cuantifica el impacto de la enfermedad de las vías aéreas respiratorias en el estado de salud y el bienestar percibido por los pacientes respiratorios y, al mismo tiempo, refleja los cambios en la actividad de la enfermedad, correlacionándose significativamente con la disnea y el FEV1. Se trata de un cuestionario compuesto con 50 preguntas repartidas en 3 dimensiones: síntomas (8), actividad (16) e impacto en la vida diaria (26). Todas las preguntas hacen referencia al estado actual del paciente, salvo las correspondientes a los síntomas, cuyo periodo recordatorio es el último año. Cada una de las respuestas tiene establecida una ponderación para el cálculo de la puntuación de las dimensiones y el total del cuestionario, que oscila entre 0 (ausencia de alteración) y 100 (máxima alteración). La diferencia mínima que se considera relevante es de 4 puntos.
Artículos relacionados
-
31 Oct 2024Medicamentos con nuevos principios activos o biosimilares Medicamentos con nuevos principios activos o biosimilares
-
7 Oct 2024Medicamentos con nuevos principios activos o biosimilares Medicamentos con nuevos principios activos o biosimilares
-
6 Ago 2024Medicamentos con nuevos principios activos o biosimilares Medicamentos con nuevos principios activos o biosimilares