Olaparib ▼Lynparza® (AstraZeneca) en cáncer de ovario, cáncer de trompa de Falopio y cáncer de peritoneo
 Nº392
Nº392
Resumen
El olaparabib es un agente antineoplásico que actúa como inhibidor de varios isoenzimas (1, 2 y 3) de la familia de las PARP (poli-ADP-ribosa polimerasas), implicadas en los mecanismos de reparación del ADN, tanto en células normales como neoplásicas. El olaparib actúa selectivamente sobre líneas celulares con BRCA mutante o con baja expresión BRCA, especialmente con respecto al BRCA2. Ha sido autorizado como medicamento huérfano para la monoterapia para el tratamiento de mantenimiento de pacientes adultas con cáncer de ovario epitelial seroso de alto grado, trompa de Falopio, o peritoneal primario, con mutación BRCA (germinal y/o somática), sensible a platino, en recaída, que están en respuesta (respuesta completa o parcial) a quimioterapia basada en platino. Los datos clínicos disponibles indican que el medicamento es capaz de prolongar significativamente 3,6 meses la supervivencia de las pacientes en ausencia de progresión tumoral con relación al placebo, periodo que llega a los 6,9 meses en el caso de aquellas con estatus BRCA mutante.
ASPECTOS FISIOPATOLÓGICOS
El carcinoma de ovario ocupa el quinto lugar entre las neoplasias que afectan a la mujer y constituyó en 2015 el 3,7% de los nuevos diagnósticos de cáncer en las mujeres españolas (con una estimación de 3.395 casos), en línea con la prevalencia europea (4,0%) y mundial (3,6%); asimismo, la mortalidad prevista para 2015 por este motivo es del 4,8% en España, 5,4% en la Unión Europea y 4,3% a nivel mundial (IARC, 2012). Estos porcentajes indican claramente que el cáncer de ovarios es una forma relativamente común de cáncer en la mujer y que su mortalidad es significativa. En este sentido, se estima que el riesgo de desarrollar cáncer de ovario a lo largo de la vida es de un 1,8%. Dicho riesgo aumenta a partir de la quinta década, con un máximo en la octava. La supervivencia global a los 5 años tras el diagnóstico se sitúa en Europa en un 44%, que se reduce al 27% para las pacientes diagnosticadas con fases avanzadas (Siegel, 2014).
Debido a la localización pélvica de los ovarios, su principal vía de extensión es a las estructuras pélvicas adyacentes. El desprendimiento de células neoplásicas a la cavidad peritoneal da lugar a su diseminación peritoneal, muy frecuente, con extensión de los implantes por toda la cavidad abdominal. Por vía linfática se puede diseminar a los ganglios retroperitoneales e iliacos y, finalmente, menos frecuentemente y en estadios avanzados, se puede extender por vía hematógena a hígado, pulmón, hueso y cerebro. Más de un 75% de los casos se diagnostica en estadios avanzados y, a pesar de la mejora en los tratamientos, la mayoría de las pacientes recaerán, convirtiéndose en una enfermedad incurable en el 50-60% de los casos.
Aproximadamente el 90% de los tumores primarios malignos del ovario son de origen epitelial (carcinomas) y derivan del epitelio de superficie del ovario, específicamente de quistes de inclusión. Los tumores no epiteliales constituyen menos del 10% de los tumores ováricos y, entre ellos, pueden citarse a los tumores de los cordones sexuales y los tumores de células germinales (Martínez Jáñez, 2011).
El carcinoma epitelial de ovario es una enfermedad heterogénea, en la que los distintos subtipos histológicos representan en realidad enfermedades diferentes desde el punto de vista clínico, histopatológico y molecular. Estas diferencias se han tratado de englobar en dos amplias categorías: los tumores tipo I y los tumores tipo II, grupos que hacen referencia a las vías tumorigénicas y no a la histopatología. Los tumores epiteliales de ovario más comunes (70%) son de tipo seroso papilar, seguidos de los endometrioides (20%), los de células claras (5%) y los mucinoides (2%); los de Brenner (células transicionales y el carcinosarcoma (tumor maligno mülleriano mixto) son raros.
Los síntomas iniciales son vagos e inespecíficos y comunes a muchos otros procesos, lo que dificulta su diagnóstico, que se suele hacer en estadios avanzados. Los síntomas que se presentan con mayor frecuencia y gravedad son: dolor abdominal, distensión abdominal, estreñimiento, pesadez pospandrial, sangrado vaginal, alteraciones de la menstruación, dispareunia, astenia, anorexia, náuseas, dolor de espalda o polaquiuria. En la exploración física es común la palpación de una masa pélvica y la presencia de ascitis en la enfermedad avanzada.
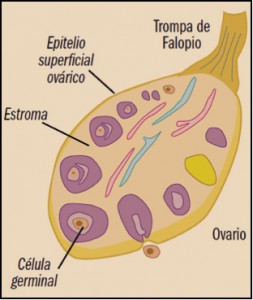
Se han identificado diversos factores de riesgo asociados al desarrollo del carcinoma de ovario, como la raza blanca, la nuliparidad, la infertilidad, la menarquia precoz y la menopausia tardía, el uso de terapia hormonal sustitutiva y factores ambientales como el talco y el tabaco, la endometriosis y la obesidad. Además, existen factores genéticos responsables de un 10-15% de los carcinomas de ovario; alrededor del 75% de estas familias tiene el síndrome de cáncer de mama y ovario familiar, con pérdida de la función de los genes supresores de tumores BRCA-1 y BRCA-2, involucrados en la reparación del ADN. El síndrome de cáncer de colon hereditario no polipósico (HNPCC, síndrome de Lynch tipo II) es responsable del 10-15% del resto de los casos de carcinomas de ovario hereditarios y está asociado a una mutación en los genes MSH-2, MLH-1 o MSH-6, por la que además de incrementar el riesgo de cáncer de colon o de endometrio, aumenta el riesgo de carcinoma de ovario.
Por su parte, entre los factores protectores se han descrito la paridad, el uso de anticonceptivos orales, la lactancia materna y la realización de histerectomía y ligadura de trompas.
Los principales factores pronósticos son la edad, el estadio tumoral, el volumen residual del tumor tras la cirugía, el subtipo histológico y el grado y los niveles de CA-125 (una glucopreoteína). El subtipo histológico de células claras y el mucinoso son los de peor pronóstico; por su parte, el endometrioide presenta mejor pronóstico que el seroso. El grado histológico es de particular importancia en las pacientes con estadios iniciales, ya que en aquellos con estadio I pobremente diferenciado tienen peor supervivencia. La mutación de los genes BRCA1 y 2 son un factor pronóstico favorable, incrementando la supervivencia libre de progresión tumoral y la supervivencia global de forma significativa.
La cirugía es el abordaje terapéutico inicial del carcinoma de ovario. Se inicia con una laparotomía reglada, diagnóstica, de estadiaje y terapéutica. La quimioterapia adyuvante es el tratamiento aplicado tras la intervención quirúrgica, que se administra en ausencia de enfermedad detectable, con el objetivo de eliminar la enfermedad microscópica y disminuir significativamente las tasas de recaída de la enfermedad, salvo en los pacientes con estadio IA o IB, en los que la supervivencia a los 5 años es de un 90%; por el contrario, para pacientes con grado III, estadio IC o histología de células claras, el riesgo de recaída es de un 20-30% y estaría indicado un tratamiento de quimioterapia tras la cirugía. Actualmente, el esquema de tratamiento estándar en los estadios iniciales del cáncer de ovario se basa en la asociación de paclitaxel (o docetaxel) y carboplatino.
El objetivo de la cirugía en estadios avanzados del cáncer de ovario es conseguir la reducción máxima de la masa tumoral, eliminándola macroscópicamente por completo o dejando una mínima porción de la misma. Si existe enfermedad voluminosa o el estado físico de la paciente es malo, se opta por la quimioterapia neoadyuvante, consistente en la administración previa de la quimioterapia a la cirugía, con el objetivo de poder realizar posteriormente, en pacientes respondedores, una cirugía citorreductora de máximo esfuerzo. Además, en pacientes con mal estado general, se reducen las complicaciones quirúrgicas y la dificultad de la cirugía. La quimioterapia neoadyuvante no debe aplicarse más allá de 3-4 ciclos, puesto que cada ciclo adicional restaría supervivencia. Por ello, la quimioterapia neoadyuvante se reserva para pacientes con mal estado general o en los que se prevea que la obtención de una citorredución óptima no va a ser posible por la extensión de la enfermedad.
El esquema actual de tratamiento es la aplicación de 6 u 8 ciclos de paclitaxel más carboplatino, tras los que se pueden alcanzar medianas de supervivencia libre de progresión de hasta 20 meses y medianas de supervivencia global de hasta 57 meses en pacientes en las que se ha conseguido una citorredución óptima. Sin embargo, pese a todos estos tratamientos, el 70% de las pacientes presentará una recaída.
La justificación para el uso de la quimioterapia intraperitoneal la constituye el hecho de que el carcinoma de ovario se disemina fundamentalmente por siembra peritoneal a toda la cavidad abdominal. Con ella, se consigue una mayor concentración de los fármacos en la cavidad abdominal, aunque la penetración en el tejido tumoral puede ser limitada, por lo que el escenario para su administración es únicamente en pacientes en las que se haya conseguido una citorredución óptima, con enfermedad residual menor de 1 cm. Los principales inconvenientes son la posible compartimentación de la cavidad abdominal, su toxicidad y las potenciales complicaciones asociadas al catéter intraperitoneal, necesario para su administración.
Pese a la aplicación de los mejores tratamientos disponibles, la mayoría de las pacientes con estadio III recaerán. El objetivo de la quimioterapia en este caso es aumentar la calidad de vida, controlar los síntomas y aumentar la supervivencia libre de enfermedad y supervivencia global. En este sentido, el factor más importante a considerar es el tiempo transcurrido desde la última administración de platino, que condicionará la respuesta a ulteriores tratamientos. De acuerdo con este criterio, se han establecido varias categorías: enfermedad refractaria a platino (progresión durante o en las 4 últimas semanas tras la finalización del platino), resistente (progresión en menos de 6 meses), parcialmente sensible (entre 6 y 12 meses) y sensible (recaída tras más de 12 meses de la última dosis de platino).
En los pacientes sensibles a platino, la opción más adecuada es el retratamiento con un platino asociado a placlitaxel, DLP (doxorrubicina liposomal pegilada) o gemcitabina. En la enfermedad parcialmente sensible a platino, se pueden aplicar estos mismos esquemas, aunque aumentar el intervalo libre de platino puede hacer que la paciente se vuelva más sensible a un retratamiento con platino y la respuesta sea mayor. Otros estudios han mostrado que la combinación de trabectedina más DLP ofrece ventajas en este subgrupo, aumentando la supervivencia global en comparación con DLP sola.
El pronóstico de las pacientes con enfermedad resistente y refractaria a platino es malo. Presentan una limitada respuesta a la quimioterapia y los tratamientos disponibles hasta ahora ofrecen porcentajes de respuesta del 10 al 15%. Se utilizan DLP, topotecán, trabectedina, paclitaxel o docetaxel, y gemcitabina. Otros tratamientos consisten en el bevacizumab, un agente anticuerpo monoclonal antiangiogénico que bloquea todas las isoformas del VEGF (Factor de crecimiento endotelial vascular), que está sobreexpresado frecuentemente en el carcinoma de ovario y se asocia con progresión de la enfermedad, formación de ascitis y peor pronóstico. Se han registrado tasas de respuesta de hasta un 17% en monoterapia en pacientes politratadas y resultados aún mejores en combinación con quimioterapia (paclitaxel y carboplatino) en líneas avanzadas.
Una posible diana farmacológica potencialmente útil es esta indicación es la denominada PARP (poli ADP-ribosa polimerasas), una familia de enzimas implicada en la reparación de la cadena simple del ADN, tanto en células normales como neoplásicas. En las células normales existe un mecanismo alternativo para reparar el ADN que requiere la intervención de dos proteínas, BRCA1 y BRCA2, facilitando la vía de la recombinación homóloga. En el carcinoma de ovario hereditario, los genes BRCA1 y BRCA2 están mutados; sin embargo, en el carcinoma de ovario esporádico, se postula que puede existir también algún tipo de disfunción de esta vía, aunque no se encuentre la mutación. Por ello, la utilización de inhibidores de PARP podría hacer a las células más quimiosensibles, por el hecho de que todos sus sistemas de reparación del ADN estarían bloqueados. Este ha sido el origen de los inhibidores de PARP, entre los que cabe citar el iniparib y el olaparib.
ACCIÓN Y MECANISMO
El olaparabib es un agente antineoplásico que actúa como inhibidor de varios isoenzimas (1, 2 y 3) de la familia de las PARP (poli-ADP-ribosa polimerasas), implicadas en los mecanismos de reparación del ADN, tanto en células normales como neoplásicas. Ha sido autorizado para la monoterapia para el tratamiento de mantenimiento de pacientes adultas con cáncer de ovario epitelial seroso de alto grado, trompa de Falopio, o peritoneal primario, con mutación BRCA (germinal y/o somática), sensible a platino, en recaída, que están en respuesta (respuesta completa o parcial) a quimioterapia basada en platino.
Las PARP – Poly (ADP-ribose) Polymerases, en inglés – constituyen una amplia familia de proteínas implicadas en un gran número de procesos celulares, pero fundamentalmente en los procesos de reparación del ADN y de muerte programada (apoptosis) de la célula. La importancia de este mecanismo de reparación del ADN en el tratamiento de determinadas formas de cáncer viene determinado por el hecho de que las células sanas (no malignas) disponen de otros mecanismos alternativos a dichos mecanismos reparadores, pero algunos tipos tumorales presentan tales mecanismos alternativos deteriorados o inactivados, lo que impide que los daños del ADN puedan ser subsanados y ello conduce al deterioro y a la muerte celular al activarse los mecanismos de apoptosis.
Uno de los mecanismos alternativos a las PARP consiste en la intervención de dos proteínas, BRCA1 y BRCA2. Cuando uno de estos genes tiene una mutación, el daño al ADN no puede repararse adecuadamente y, como resultado, las células tienen más probabilidad de presentar alteraciones genéticas adicionales que pueden conducir al cáncer. En torno al 40% de las mujeres que heredan una mutación dañina del BRCA1 y 15% de las que heredan una mutación dañina del BRCA2 padecerán cáncer de ovario a lo largo de su vida; las mutaciones conjuntas en el BRCA1 y en el BRCA2 están presentes en cerca del 15% de los cánceres de ovarios en general.
En el carcinoma de ovario hereditario, los genes BRCA1 y BRCA2 están mutados; adicionalmente, se postula que también en el carcinoma de ovario esporádico puede existir algún tipo de disfunción de esta vía, aunque no se encuentre la mutación específica.
El olaparib actúa selectivamente sobre líneas celulares con BRCA mutante o con baja expresión BRCA, especialmente con respecto al BRCA2. Por ello, se espera que el fármaco tenga efectos mínimos sobre las células normales (sin mutaciones o heterocigóticas para BRCA1 o BRCA2). El olaparib ha demostrado carecer de efectos significativos a concentraciones terapéuticas (<10 µM) sobre un amplio panel de potenciales dianas farmacológicas, incluyendo enzimas, receptores, transportadores y canales iónicos, al margen de su actividad sobre las PARP.
ASPECTOS MOLECULARES
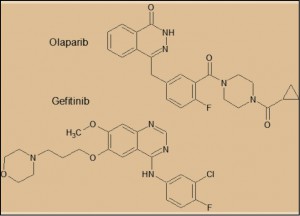
El olaparib es el primer miembro de la serie de inhibidores de las PARP que ha sido comercializado. Inicialmente, se investigó también al iniparib, pero su investigación fue detenida por la compañía titular (Sanofi) en 2013, debido a sus resultados clínicos insatisfactorios.
Aunque farmacológicamente el olaparib tiene un mecanismo de acción diferente del de los demás antineoplásicos actualmente utilizados, en términos estructurales guarda un inequívoco paralelismo químico con la serie de los inhibidores de tirosina cinasas (“inib”), particularmente con el gefitinib y otros como vandetanib, afatinib, lapatinib o erlotinib; todos ellos tienen un núcleo quinazolínico, mientras que en el caso del olaparib es ftalazínico. Igualmente, el olaparib lleva ligado un resto bencílico, que es de fenilamina en los inhibidores de tirosina cinasas, con la presencia de un átomo de flúor. Este paralelismo estructural, al menos en una parte de la molécula, sugiere que el mecanismo de bloqueo inhibitorio de las enzimas diana es similar, aunque las diferencias en el resto de la molécula sea el determinante de la especificidad del sustrato que, en el caso de los “inib” son diversas tirosina cinasas mientras que son las PARP con los “parib”.
EFICACIA Y SEGURIDAD CLÍNICAS
La eficacia y la seguridad clínicas del olaparib han sido adecuadamente contrastadas en las indicaciones autorizadas mediante un ensayo clínico principal de fase II (información de la eficacia y ampliación de datos de seguridad), aleatorizado, multicéntricos, doblemente ciego, multicéntrico (82), multinacional (16 países, de Europa, América del Norte y Australia) y controlado con placebo.
Los criterios de inclusión fueron el diagnóstico histológico de cáncer de ovario seroso, incluyendo cáncer peritoneal primario y cáncer de trompa de Falopio, haber completado al menos dos regímenes de quimioterapia con complejos de platino; los pacientes debían presentar una recaída platino-sensible (ausencia de progresión tumoral durante al menos seis meses tras la última dosis de platino) y en con último régimen de platino debían haber experimentado una respuesta, al menos, parcial. La pauta posológica fue de 400 mg/12 h de olaparib (oral) de forma continua (en ciclos de 28 días), manteniéndose el tratamiento hasta la detección de progresión tumoral.
La variable primaria de eficacia utilizada fue la supervivencia en ausencia (libre) de progresión tumoral, definida como el periodo de tiempo transcurrido desde la inclusión aleatoria en el grupo de tratamiento hasta la aparición de algún dato objetivo sugerente de progresión tumoral. Como variables secundarias de eficacia se utilizaron la supervivencia global (tiempo desde aleatorización hasta muerte por cualquier causa), mejor respuesta global (respuesta tumoral completa o parcial, estabilización, etc.), tasa de control tumoral (porcentaje de pacientes con respuesta objetiva en la primera visita o estabilización tumoral durante al menos 23 semanas), variación del tamaño tumoral y algunos otras. Las características antropométricas, fisiopatológicas y terapéuticas, así como los resultados del ensayo clínico están recopilados en la tabla 1.
|
Tabla 1. Estudio clínico de fase 2 con olaparib controlado con placebo |
|
|
Pacientes aleatorizados |
245 |
|
Edad (mediana) |
58,5 años (70% <65 años) |
|
Raza (% blancos) |
97% |
|
Tumor primario (ovario) |
86,0% |
|
Tumor primario (peritoneo) |
11,4% |
|
Tumor primario (trompa de Falopio) |
2,6% |
|
Tumor poco o nada diferenciado |
72% |
|
Tiempo transcurrido desde la progresión tumoral más reciente (mediana) |
191 días |
|
Tiempo transcurrido desde el último régimen con platino (mediana) |
40 días |
|
% Pacientes con 2-3 regímenes qumioterápicos previos |
74% |
|
% Pacientes con ≥4 regímenes qumioterápicos previos |
26% |
|
% Pacientes con 2-3 regímenes qumioterápicos CON PLATINO previos |
86% |
|
% Pacientes con ≥4 regímenes qumioterápicos CON PLATINO previos |
14% |
|
% Pacientes con terapia hormonal o inmunológica previa |
13,2% |
|
% Pacientes con radioterapia previa |
6,8% |
|
BRCA con estatus mutante |
36% |
|
BRCA con estatus desconocido |
22% |
|
Supervivencia libre de progresión tumoral (mediana) |
Olaparib: 8,4 meses Placebo: 4,8 meses |
|
Supervivencia libre de progresión tumoral (mediana), en pacientes con BRCA mutante |
Olaparib: 11,2 meses Placebo: 4,3 meses |
|
Supervivencia global (mediana) |
Olaparib: 29,8 meses (ns) Placebo: 27,8 meses (ns) |
|
Supervivencia global (mediana), en pacientes con BRCA mutante |
Olaparib: 34,9 meses (ns) Placebo: 31,9 meses (ns) |
|
Tasa de control tumoral a las 24 semanas (% pacientes) |
Olaparib: 53,7% Placebo: 25,6% |
|
% Pacientes con respuesta completa o parcial confirmada |
Olaparib: 12,0% Placebo: 4,2% |
|
Variación del tamaño tumoral (%) a las 24 semanas |
Olaparib: -0,8% Placebo: +26,4% |
|
Tiempo transcurrido (mediana) hasta el inicio de un tratamiento posterior o muerte |
Olaparib: 13,4 meses Placebo: 6,7 meses |
|
Tiempo transcurrido (mediana) hasta el inicio de un tratamiento posterior o muerte, en pacientes con BRCA mutante |
Olaparib: 15,6 meses Placebo: 6,2 meses |
|
Referencia |
Ledermann, 2014 |
|
Todas las diferencias en los valores de las variables obtenidos con olaparib y con placebo fueron estadísticamente significativas, salvo aquellas notadas con (ns). |
|
Desde el punto de vista de la seguridad, destacan por encima de todo los eventos adversos de naturaleza gastrointestinal y hematológica, siendo los más comunes náusea (71% con olaparib vs. 36% con placebo), fatiga (52 vs. 39%), vómitos (35 vs. 14%), diarrea (27 vs. 24%), dolor abdominal (25 vs. 27%), anemia (21 vs. 5,5%), estreñimiento (21 vs. 11%), cefalea (21 vs. 13%), dolor epigástrico (18 vs. 8,6%), tos (18 vs. 10%), dispepsia (18 vs. 8,6%), artralgia (18 vs. 14%), dolor de espalda (17 vs. 11%), disgeusia (16 vs. 6,3%), nasofaringitis (15 vs. 11%), astenia (14 vs. 9,4%), mareos (14 vs. 7,0%), distensión abdominal (13 vs. 8,6%), disnea (13 vs. 6,3%) e infección del tracto respiratorio superior (13 vs. 6,3%).
Las respectivas frecuencias de eventos adversos de grado 3 o superior (severos) emergentes durante el tratamiento fue del 41,2% (olaparib) vs. 21,9% (placebo) y, en el caso de los pacientes con estatus BRCA mutante fue del 39,2 vs. 17,7%. En este sentido, los más frecuentes fueron anemia (11% en todos los pacientes tratados con olaparib y 13% específicamente aquellos con estatus BRCA mutante), leucopenia (2,7 y 3,5%), neutropenia (2,9 y 3,3%), dolor abdominal (3,3 y 4,0%), obstrucción intestinal (2,0 y 3,3%), vómitos (3,3 y 4,0%) y fatiga (7,1 y 7,3%).
La incidencia de eventos adversos graves (serios) fue del 18,4 v. 8,6% en el conjunto de todos los pacientes y del 21,6 vs. 9,7% con BRCA mutante. Finalmente, los porcentajes de pacientes que suspendieron el tratamiento por este motivo fueron del 4,4 vs. 1,6% en general y 6,8 vs, 0% en aquellos con BRCA mutante.
ASPECTOS INNOVADORES
El olaparabib es un agente antineoplásico que actúa como inhibidor de varios isoenzimas (1, 2 y 3) de la familia de las PARP (poli-ADP-ribosa polimerasas), implicadas en los mecanismos de reparación del ADN, tanto en células normales como neoplásicas. Uno de los mecanismos alternativos a las PARP consiste en la intervención de dos proteínas, BRCA1 y BRCA2. Cuando uno de estos genes tiene una mutación, el daño al ADN no puede repararse adecuadamente y, como resultado, las células tienen más probabilidad de presentar alteraciones genéticas adicionales que pueden conducir al cáncer. En torno al 40% de las mujeres que heredan una mutación dañina del BRCA1 y 15% de las que heredan una mutación dañina del BRCA2 padecerán cáncer de ovario a lo largo de su vida; las mutaciones conjuntas en el BRCA1 y en el BRCA2 están presentes en cerca del 15% de los cánceres de ovarios en general. En este sentido, en el carcinoma de ovario hereditario, los genes BRCA1 y BRCA2 están mutados, aunque se postula que también en el carcinoma de ovario esporádico puede existir algún tipo de disfunción de esta vía. El olaparib actúa selectivamente sobre líneas celulares con BRCA mutante o con baja expresión BRCA, especialmente con respecto al BRCA2.
El olaparib ha sido autorizado como medicamento huérfano para la monoterapia para el tratamiento de mantenimiento de pacientes adultas con cáncer de ovario epitelial seroso de alto grado, trompa de Falopio, o peritoneal primario, con mutación BRCA (germinal y/o somática), sensible a platino, en recaída, que están en respuesta (respuesta completa o parcial) a quimioterapia basada en platino.
Los datos clínicos procedentes del principal ensayo clínico (de fase II, todavía en curso) indican que el medicamento es capaz de prolongar significativamente 3,6 meses la supervivencia de las pacientes en ausencia de progresión tumoral con relación al placebo, periodo que llega a los 6,9 meses en el caso de aquellas con estatus BRCA mutante. Asimismo, también se ha comprobado la superioridad frente al placebo en otras variables secundarias de eficacia, como la tasa de control tumoral a las 24 semanas (53,7 vs. 25,6%), porcentaje de pacientes con respuesta completa o parcial confirmada (12,0 vs. 4,2%) o la variación del tamaño tumoral a las 24 semanas (-0,8 vs. +26,4%). Con los datos actualmente disponibles, no se ha encontrado ningún incremento (ni reducción) de la supervivencia global, esperando que esta cuestión quede definitivamente establecida con la finalización del estudio (a mediados de 2017).
El análisis conjunto de estos datos con los correspondientes a otros estudios de fase II (Matulonis, 2016) indican unas tasas de respuesta objetiva global del 36% (IC95% 30 a 42) y del 31% (IC95% 25 a 38) entre aquellas pacientes que habían recibido tres o más tratamiento quimioterápicos, con una duración media de la respuesta de 7,4 y 7,8 meses, respectivamente.
Los eventos adversos asociados al tratamiento son muy frecuentes, aunque generalmente de bajo grado y manejables clínicamente; destacan por encima de todo los eventos adversos de naturaleza gastrointestinal y hematológica. Los eventos adversos de grado 3 o superior (severos) más comunes son anemia, leucopenia, neutropenia, dolor abdominal, obstrucción intestinal, vómitos y fatiga.
Actualmente, existe alguna alternativa (aunque no específica para los tumores BRCA mutantes), como el bevacizumab asociado a carboplatino y gemcitabina, con datos de supervivencia libre de progresión tumoral 4 meses mayores que con placebo y sin afectar aparentemente a la supervivencia global. Estos datos están en la misa línea que los obtenidos con olaparib, aunque – como siempre – hay que tener presente que estas comparaciones indirectas carecen de rigor, tanto cualitativa como cuantitativamente. En cualquier caso, según el Informe de Posicionamiento Terapéutico (AEMPS, 2016), puede considerarse a este nuevo medicamento – hasta disponer de los datos finales del estudio en fase III actualmente en curso – como tratamiento de elección en pacientes que cumplan todos los siguientes criterios: recaída de un cáncer de ovario, trompa de Falopio o primario peritoneal que se haya producido más de 6 meses después de la finalización del penúltimo tratamiento con platino; respuesta al tratamiento con platino realizado para la última recaída; al menos dos terapias con platino (incluyéndose la inicial y la de la última recaída); mutación en BRCA 1 y/o BRCA 2 (germinal o somática).
Quedan muchas cuestiones por resolver, incluyendo la disponibilidad efectiva y generalizada de los sistemas de análisis del estatus BRCA y la optimización de la indicación (mantenimiento o recaída tumoral). Además, es preciso conocer más acerca de los posibles efectos a medio y largo plazo, particularmente sobre el riesgo de mielodisplasia y de leucemia mieloide aguda, para lo que también se esperan los resultados del estudio en fase III en curso (McLachlan, 2016).
En definitiva, un fármaco que aporta un nuevo e interesante mecanismo de acción antineoplásico ligado a marcadores tumorales muy específicos, lo que amplía el abanico de opciones terapéuticas disponibles, aunque con resultados clínicos muy modestos y con un margen importante de incertidumbre. Con todo, este mecanismo podría tener implicaciones sustanciales en diversos tumores sólidos, como mama, estómago y páncreas (Bornstein, 2016).
|
VALORACIÓN |
|
OLAPARIB |
|
Grupo Terapéutico (ATC): L01XX. AGENTES ANTINEOPLÁSICOS E INMUNOMODULADORES. Otros |
|
Indicaciones autorizadas: Monoterapia para el tratamiento de mantenimiento de pacientes adultas con cáncer de ovario epitelial seroso de alto grado, trompa de Falopio, o peritoneal primario, con mutación BRCA (germinal y/o somática), sensible a platino, en recaída, que están en respuesta (respuesta completa o parcial) a quimioterapia basada en platino. |
|
INNOVACIÓN moderada. Aporta algunas mejoras, pero no implica cambios sustanciales en la terapéutica estándar |
|
Novedad clínica: Mejora la eficacia clínica con relación al tratamiento estándar. |
|
Novedad molecular: Incorpora un mecanismo de acción innovador frente al de los tratamientos previamente disponibles para la misma o similar indicación terapéutica. |
BIBLIOGRAFÍA
Bibliografía
- Agencia Española de Medicamentos y Productos Sanitarios (AEMPS). Informe de Posicionamiento Terapéutico de Olaparib (Lynparza®) en el cáncer de ovario (Fecha de publicación: 21 de enero de 2016). http://www.aemps.gob.es/medicamentosUsoHumano/informesPublicos/docs/IPT-olaparib-Lynparza.pdf
- Bornstein E, Jimeno A.Olaparib for the treatment of ovarian cancer. Drugs Today (Barc). 2016; 52(1): 17-28. doi: 10.
- Consejo General de Colegios Oficiales de Farmacéuticos. Bot PLUS WEB. https://botplusweb.portalfarma.com/
- European Medicines Agency (EMA). Lynparza®.European Public Assessment Report (EPAR). EMA/662514/2014; EMEA/H/C/003726. http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_-_Public_assessment_report/human/003726/WC500180154.pdf
- International Agency for Reasearch on Cancer (IARC). World Health Organization. GLOBOCAN 2012; Estimated Cancer Incidence, Mortality and Prevalence in 2012. http://globocan.iarc.fr/Pages/burden_sel.aspx
- Ledermann J, Harter P, Gourley C, Friedlander M, Vergote I, Rustin G, et al.Olaparib maintenance therapy in patients with platinum-sensitive relapsed serous ovarian cancer: a preplanned retrospective analysis of outcomes by BRCA status in a randomised phase 2 trial. Lancet Oncol. 2014; 15(8): 852-61. doi: 10.1016/S1470-2045(14)70228-1.
- Martínez Jáñez N, Guerra Alía EM, Crespo Massieu C, Carrato Mena A.Terapéutica farmacológica de los tumores ginecológicos. En: Terapéutica farmacológica de los trastornos neoplásicos e inmunológicos. Consejo General de Colegios Oficiales de Farmacéuticos. Madrid; 2011. p. 221-44.
- Matulonis UA, Penson RT, Domchek SM, Kaufman B, Shapira-Frommer R, Audeh MW.Olaparib monotherapy in patients with advanced relapsed ovarian cancer and a germline BRCA1/2 mutation: a multi-study analysis of response rates and safety. Ann Oncol. 2016 Mar 8. pii: mdw133.
- McLachlan J, Banerjee S.Olaparib for the Treatment of Epithelial Ovarian Cancer. Expert Opin Pharmacother. 2016 Mar 11. [Epub ahead of print]
- Siegel R, Ma J, Zou Z, Jemal A. Cancer statistics, 2014. CA Cancer J Clin. 2014; 64(1): 9-29. doi: 10.3322/caac.21208.
Artículos relacionados
-
31 Oct 2024Medicamentos con nuevos principios activos o biosimilares Medicamentos con nuevos principios activos o biosimilares
-
7 Oct 2024Medicamentos con nuevos principios activos o biosimilares Medicamentos con nuevos principios activos o biosimilares
-
6 Ago 2024Medicamentos con nuevos principios activos o biosimilares Medicamentos con nuevos principios activos o biosimilares





