Opicapona ▼ Ongentys® (Bial) en enfermedad de Parkinson
 Nº403
Nº403
Resumen
La opicapona es un inhibidor periférico, de alta afinidad, reversible y selectivo de la catecol-O-metil transferasa (COMT), análogo a la tolcapona y entacapona. Esta inhibición de la COMT a nivel periférico incrementa la disponibilidad de la levodopa en el sistema nervioso central, prolongando los efectos antiparkinsonianos de la levodopa. Debido a la elevada afinidad de la opicapona por la COMT la velocidad de disociación de esta unión es baja, lo que permite mantener un efecto estable sobre los niveles plasmáticos de levodopa con una única dosis diaria de opicapona. El medicamento ha sido autorizado oficialmente como terapia adyuvante a las preparaciones de levodopa/inhibidores de la DOPA descarboxilasa (carbidopa/benserazida) en pacientes adultos con enfermedad de Parkinson y fluctuaciones motoras de final de dosis que no puedan ser estabilizados con estas combinaciones.
ASPECTOS FISIOPATOLÓGICOS
La enfermedad de Parkinson es un trastorno degenerativo del sistema nervioso central que se caracteriza por la degeneración progresiva de las neuronas dopaminérgicas de la pars compacta de la sustancia negra (SNpc) (Figura 1). Es característica la presencia de cuerpos de Lewy en los núcleos pigmentados del encéfalo. Se trata de inclusiones hialinas eosinófilas con un núcleo esférico denso, sobre el que se acumulan neurofilamentos, enzimas (como fosfatasas y cinasas) y otras proteínas citosólicas, principalmente alfa-sinucleína, de ahí que algunos autores incluyan esta enfermedad dentro del grupo de las sinucleinopatías.
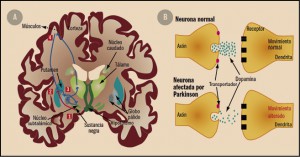
Figura 1. Bases fisiopatológicas de la enfermedad de Parkinson. A: 1: Las neuronas que forman la sustancia negra producen dopamina. 2: La dopamina se libera en el estriado actuando sobre sus neuronas. El mecanismo alterado de liberación y recaptación de dopamina produce una alteración en la concentración y acción de la dopamina en el núcleo estriado. 3: El estriado envía los impulsos al resto de los ganglios basales y de ahí al tálamo. 4: Desde el tálamo se envían a la corteza cerebral motora y, desde allí, a los músculos. B: En la enfermedad de Parkinson se produce una alteración en la concentración y acción de la dopamina en el núcleo estriado, dando lugar a movimientos alterados.
Todo lo anterior se traduce en una disminución muy importante del contenido de dopamina en el estriado (estructura a la que proyecta de forma preferente la SNpc), lo cual es principal responsable de la aparición de los síntomas motores característicos de la enfermedad, como temblor, bradicinesia y rigidez muscular; y también de algunos no motores, como depresión, ansiedad y trastornos del sueño y autonómicos, que pueden preceder al desarrollo de la enfermedad en varios años. En estadios avanzados pueden existir también alteraciones de la postura y del equilibrio. No suele haber un deterioro cognitivo precoz y, cuando existe, generalmente se debe a otros motivos. Una manifestación clínica característica es el comienzo asimétrico de los síntomas, y esa asimetría se mantiene a lo largo de toda la evolución de la enfermedad.
En los seres humanos, la pars compacta de la sustancia negra contiene, aproximadamente, 450.000 neuronas dopaminérgicas. El mecanismo último responsable de su muerte, y concretamente la causa que hace a estas neuronas especialmente vulnerables, es desconocido, pero parece que su causa directa de muerte es mediante mecanismos apoptóticos, en los que se han implicado diversos factores (neurotróficos, inmunes, excitotoxicidad, disfunción mitocondrial y del metabolismo oxidativo, etc.).
Además de lo indicado en relación a las neuronas dopaminérgicas de la pars compacta de la sustancia negra, en la enfermedad de Parkinson se produce también la degeneración de otras poblaciones neuronales, entre las que destacan:
- Neuronas del bulbo olfatorio, que se correlaciona con la anosmia1 del parkinsoniano.
- Distintas estructuras subcorticales, como neuronas colinérgicas del núcleo basal de Meynert, catecolaminérgicas del locus coeruleus y áreas de la corteza entorrinal, un importante centro de la memoria.
- Neuronas simpáticas y parasimpáticas ganglionares, cuya pérdida se relaciona con las disfunciones autonómicas.
- Núcleos serotonérgicos y noradrenérgicos, causando alteraciones del comportamiento, incluyendo depresión.
La prevalencia de esta enfermedad (proporción de la población que está afectada) está claramente relacionada con la edad; de hecho, es considerada como una enfermedad rara antes de los 40 años: 3-4 casos por cada 100.000 habitantes. Por su parte, la incidencia global anual (nuevos casos aparecidos durante el año) es de unos 5 casos por cada 100.000 habitantes, con un pico de incidencia entre los 60 y los 69 años. No se han descrito diferencias entre razas. En España, los datos de prevalencia oscilan entre 160 y 1.500 casos por 100.000 habitantes, con un carácter marcadamente progresivo con la edad: 3,3 (0-39 años), 16,5 (40-49), 100 (50-59), 400-630 (60-69), 950-1.800 (70-79) y 1.000-10.400 (≥80).
Globalmente, la supervivencia de los pacientes parkinsonianos se reduce aproximadamente en un 5% anualmente, aunque con amplias variaciones. En los estudios post mortem, la duración media de la enfermedad desde el diagnóstico hasta la muerte oscilan entre 6,9 y 14,3 años, aumentando la mortalidad comparada especialmente en las personas de más edad y con demencia.
La gran mayoría de los tratamientos farmacológicos disponibles están orientados a restablecer el contenido de dopamina estriatal. Otro abordaje terapéutico en continuo desarrollo consiste en el diseño de fármacos que bloqueen la cascada de eventos moleculares que tienen lugar en las neuronas dopaminérgicas de la SNpc, responsables de la muerte neuronal, con la finalidad de poder realizar un tratamiento neuroprotector que frene la evolución progresiva de la enfermedad. Sin embargo,
La mayoría de las terapias ensayadas con un objetivo neuroprotector se basan en los resultados obtenidos en modelos experimentales de la enfermedad de Parkinson y la mayoría de los estudios que han mostrado su eficacia en el laboratorio ha fallado cuando se ha aplicado a la clínica; actualmente, solo la rasagilina (1 mg/día) ha demostrado ser capaz de modificar el curso evolutivo de la enfermedad y ello de forma muy leve. Por todo ello, el tratamiento farmacológico actual de la enfermedad de Parkinson tiene un carácter fundamentalmente sintomático.
En el momento actual se suele iniciar el tratamiento tan pronto como se establezca el diagnóstico, ya que ello da lugar a una mejor evolución clínica. La elección del fármaco depende, en cada caso individual, de la demanda funcional, la limitación del sujeto para las actividades de la vida diaria, la presencia de comorbilidad o la necesidad de otros tratamientos.
La levodopa es un precursor de la dopamina y, administrada en asociación con carbidopa o cualquier otro inhibidor de la dopa-descarboxilasa periférica (IDD), es el fármaco más eficaz para controlar los síntomas motores de la enfermedad. Atraviesa la barrera hematoencefálica y se convierte en dopamina en las terminales dopaminérgicas nigroestriadas, donde se almacena en las vesículas presinápticas hasta su liberación. La asociación de levodopa e IDD resulta eficaz en cualquier estadio de la enfermedad de Parkinson. La rigidez y la bradicinesia son los síntomas que mejoran más, mientras que el temblor y los síntomas axiales (trastornos posturales y del equilibrio, disfagia, freezing, etc.) responden en menor medida.
Aunque todos los pacientes mantienen una respuesta favorable de sus síntomas a la levodopa, no todos ellos mantienen una respuesta estable. Al cabo de 2-5 años de tratamiento, alrededor de un 80% de los pacientes desarrolla complicaciones motoras en forma de fluctuaciones y movimientos involuntarios o discinesias (sobre todo en pacientes que inician su enfermedad antes de los 60 años), que tienen un impacto negativo en su calidad de vida. Las fluctuaciones motoras, referidas habitualmente como fenómenos on-off, son una sucesión de respuestas de corta duración que aparecen con cada una de las dosis de levodopa; en este sentido, cabe indicar que una fase off se define como la lentitud (bradicinesia) o falta de movilidad (acinesia), mientras que la fase on se caracteriza porque el paciente siente que su movilidad es adecuada, con independencia de que presente alguna discinesia. Las fluctuaciones motoras mejoran inicialmente cuando se administra el medicamento fuera de las comidas, lo que sugiere que la mayoría de estas fluctuaciones tiene un origen farmacocinético, hipótesis que es avalada por la práctica desaparición de las fluctuaciones motoras en sujetos tratados con infusiones duodenales de levodopa (Duodopa®), que supone un aporte constante de levodopa.
La gran cantidad de radicales libres que se generan en el metabolismo de la dopamina hizo pensar a algunos investigadores que la levodopa podría acelerar el curso progresivo de la enfermedad. Ello hizo que, durante muchos años, el tratamiento con levodopa se retrasara hasta que el paciente desarrollara un cierto grado de incapacidad motora. Sin embargo, hoy en día no existe ninguna evidencia sobre la toxicidad de la levodopa y, de hecho, la mayoría de las guías terapéuticas indican que la levodopa con IDD (200-1.000 mg, repartidos en 3 o 4 dosis) debe ser el tratamiento de inicio en pacientes con enfermedad de Parkinson y edad superior a 70 años. En menores de 70 años deben utilizarse agonistas dopaminérgicos como primera opción de tratamiento y añadir la combinación de levodopa e IDD cuando los síntomas no estén bien controlados. Deben utilizarse las dosis más bajas posibles de agonistas dopaminérgicos que proporcionen una eficacia terapéutica. Los efectos secundarios más importantes de la levodopa son náuseas, vómitos, hipotensión ortostática, somnolencia, discinesias y alucinaciones; en este sentido, la utilización de domperidona 30 minutos antes de las comidas conjuntamente con la levodopa controla de forma eficaz las manifestaciones gastrointestinales.
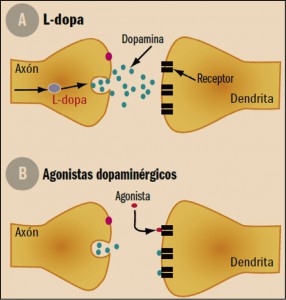
Figura 2.Mecanismo de acción de los fármacos antiparkinsonianos. A: La L-dopa entra en la neurona transmisora y se convierte en dopamina, que es liberada al espacio sináptico. B: Los agonistas dopaminérgicos estimulan directamente los receptores dopaminérgicos de la neurona del núcleo estriado.
Los agonistas dopaminérgicos actúan estimulando directamente los receptores dopaminérgicos que se encuentran en la membrana celular de las neuronas de proyección estriatales. Existen diferencias entre los distintos agonistas dopaminérgicos en base a su afinidad por los diferentes subtipos de receptores (D1, D2 o D3), su estructura química (ergóticos y no ergóticos) y semivida plasmática. Los agonistas de estructura ergótica (bromocriptina, lisurida, pergolida y cabergolina) pueden producir reacciones fibróticas serosas o valvulares cardiacas, por lo que su utilización en la clínica es muy escasa y son siempre fármacos de segunda elección. Cuando se utilizan, es necesario realizar una ecografía cardiaca cada 3 meses.
Los no ergóticos (ropinirol, pramipexol, rotigotina y apomorfina) son más utilizados que los anteriores. Todos ellos han demostrado ser eficaces en el tratamiento de las primeras fases de la enfermedad de Parkinson, sin que haya ninguna superioridad de uno frente a otro con respecto a la mejoría de los síntomas parkinsonianos o la menor incidencia de discinesias, aunque el pramipexol tiene una cierta acción antidepresiva y mejora la apatía, mientras que la rotigotina mejora las escalas de sueño, la acinesia matutina y también el humor, por lo que estaría indicado en pacientes con problemas nocturnos.
Los agonistas dopaminérgicos producen más efectos secundarios que la levodopa; los más frecuentes son: náuseas, vómitos, hipotensión ortostática, edemas maleolares, alucinaciones, ataques de sueño y trastornos del control de los impulsos (ludopatía, conductas de hipersexualidad, comidas compulsivas en forma de atracones, etc.). El trastorno del control de los impulsos es más frecuente en varones jóvenes y su aparición obliga a disminuir o interrumpir el tratamiento con estos fármacos. Algunos casos mejoran con amantadina.
Como ya se ha indicado, los agonistas dopaminérgicos son los fármacos de elección en monoterapia en el tratamiento inicial de los pacientes de inicio anterior a los 70 años, ya que producen menos complicaciones motoras (fluctuaciones y discinesias) que la levodopa, sin que ello ningún efecto neuroprotector como inicialmente se había sugerido.
Entre los inhibidores de la catecol-O-metil transferasa (COMT), el medicamento de referencia ha sido hasta ahora la entacapona, cuya administración asociada a la levodopa proporciona un incremento del número de horas del estado on de 1- 1,5 horas. Ha demostrado ser eficaz también en pacientes con fluctuaciones motoras (fenómenos on/off) leves, con una eficacia similar a la rasagilina. Históricamente, la tolcapona es el primer miembro de la serie, pero su comercialización fue suspendida en 1998 por motivos de hepatotoxicidad, rehabilitándose el registro en 2005, aunque como medicamente de hospitalario (H). Debido al riesgo de daño hepático agudo, potencialmente mortal, no se debe considerar como un tratamiento de primera línea complementario a levodopa/benserazida o levodopa/carbidopa.
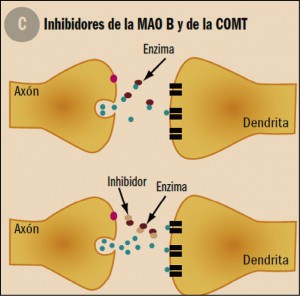
Figura 3.Mecanismo de acción de los fármacos antiparkinsonianos. C: Existen enzimas que metabolizan la dopamina. La inhibición de las mismas evita que la dopamina se degrade y pueda estimular a los receptores dopaminérgicos. COMT: catecol-o-metil-transferasa; MAO B: monoamino oxidasa tipo B.
Los fármacos anticolinérgicos son históricamente los primeros utilizados para el tratamiento de la enfermedad de Parkinson; en general, la rigidez y la bradicinesia son los síntomas que mejoran más. Su mecanismo de acción está asociado a la hiperactividad colinérgica que se crea en los ganglios basales como consecuencia de la pérdida del tono dopaminérgico estriatal. El trihexifenidilo, el biperideno y la prociclidina son fármacos anticolinérgicos muy poco utilizados actualmente por su escaso efecto antiparkinsoniano y el número importante de efectos secundarios que producen, entre los que cabe destacar: sequedad de boca, estreñimiento, visión borrosa, alteraciones cognitivas (pérdida de memoria, confusión, alucinaciones que pueden llegar a confundirse con un cuadro demencial) y retención urinaria (sobre todo en los varones). Es importante señalar que, una vez que se introducen, es muy difícil retirarlos por la reaparición de los síntomas (temblor) y que, si se eliminan bruscamente, puede aparecer un incremento de los síntomas, sobre todo del temblor (efecto rebote). Por otro lado, el tratamiento prolongado con anticolinérgicos puede favorecer el desarrollo de patologías de tipo Alzheimer en los pacientes con enfermedad de Parkinson.
La selegilina y la rasagilina son inhibidores irreversibles de la monoamino oxidasa tipo B (MAO B) y su acción antiparkinsoniana está asociada al bloqueo de una de las vías de metabolización de la dopamina, lo que se traduce en un aumento de los niveles de dopamina en el estriado. Ambas moléculas, y en especial la rasagilina, tienen una actividad antiapoptótica, al estabilizar la permeabilidad del poro mitocondrial, lo que les confiere propiedades neuroprotectoras en modelos animales de enfermedad de Parkinson, aunque tal propiedad no es tan evidente en pacientes humanos. Este tipo de fármacos pueden producir un “efecto queso” (ataques de cefalea y crisis hipertensivas en relación a la ingesta de alimentos ricos en tiramina, como queso, vino, etc.) si se utilizan dosis altas, ya que pierden su selectividad por la isoforma B y producen un incremento de los niveles plasmáticos de tiramina. No se deben utilizar cuando el paciente esté tomando inhibidores de la recaptación de serotonina, ya que estos fármacos pueden favorecer el desarrollo de un síndrome serotoninérgico caracterizado por hipertensión arterial, sudoración excesiva, mioclonías generalizadas y disminución del nivel de conciencia. Ambos IMAO pueden producirlo, pero no se han descrito casos con el uso de rasagilina.
La rasagilina es un fármaco muy utilizado en pacientes de reciente diagnóstico y síntomas parkinsonianos leves, aunque su acción antiparkinsoniana es también leve. En general, se tolera bien sin grandes efectos secundarios y, a diferencia de la selegilina, en su metabolización no se generan compuestos con actividad anfetamínica, por lo que no produce insomnio. La rasagilina ha demostrado ser eficaz también en pacientes con fluctuaciones motoras (fenómenos on/off) leves, con una eficacia similar a la entacapona, un inhibidor de la catecol-o-metil-transferasa (COMT). Su administración asociada a la levodopa proporciona un incremento del número de horas del estado on de 1- 1,5 horas. Algunos estudios han demostrado que la selegilina a dosis de 10 mg/día mejora el freezing (episodios de congelación) de la marcha en pacientes parkinsonianos.
La safinamida ha sido el último agente antiparkinsoniano comercializado en España (febrero 2016) y actúa como un inhibidor reversible (a diferencia de la selegilina y la rasagilina) y altamente selectivo (más de 1000 veces) de la MAO tipo B, lo que provoca un aumento en los niveles extracelulares de la dopamina en el cuerpo estriado. Asimismo, es capaz de reducir la liberación inducida de glutamato en los ganglios basales, sin afectar a los niveles basales de glutamato; también facilita el control de la excitabilidad neuronal mediante el bloqueo de los canales de sodio (Na+) dependientes del voltaje de forma dependiente del estado y modula los canales de calcio (Ca2+), aunque se ignora en qué medida estos mecanismos no dopaminérgicos contribuyen a su efecto antiparkinsoniano global. El medicamento ha sido autorizado para el tratamiento de pacientes adultos con enfermedad de Parkinson idiopática como tratamiento complementario a una dosis estable de levodopa sola o en combinación con otros medicamentos antiparkinsonianos, en pacientes en fase media o avanzada con fluctuaciones. No parece que presente una mayor eficacia que los otros IMAO-B.
La gran mayoría de los pacientes con enfermedad de Parkinson desarrollan al cabo de una media de 5 años de tratamiento, complicaciones motoras en forma de fluctuaciones motoras y discinesias, que en algunos casos son de difícil control. Algunos pacientes mejoran al llevar a cabo una redistribución proteica de los alimentos y al ingerir la medicación fuera de las comidas. Sin embargo, si estas medidas fallan, es preciso proceder a un reajuste farmacológico; para ello, en pacientes con fluctuaciones leves puede utilizarse selegilina o rasagilina en asociación a las dosis habituales de levodopa e IDD. Ambos fármacos proporcionan un incremento de 1-1,5 horas del tiempo en on al día y no intensifican de manera significativa las discinesias.
La sustitución de los preparados de levodopa/carbidopa por preparados que contengan además entacapona, aumentar el número diario de dosis de levodopa o asociar agonistas dopaminérgicos, en el caso de que el paciente no los esté tomando, puede ser de utilidad en algunos casos. Se recomienda la administración de agonistas dopaminérgicos de semivida larga, no ergóticos, para reducir las fluctuaciones y discinesias, ya que proporcionan una estimulación dopaminérgica más mantenida y fisiológica. No existen estudios que hayan demostrado mayor eficacia de un agonista dopaminérgico sobre otro con respecto al control de las fluctuaciones motoras. La apomorfina es un agonista dopaminérgico no ergótico que mejora los síntomas motores, considerándosele como fármaco de rescate de los periodos off. Los efectos secundarios más frecuentes son las náuseas y los vómitos. Otras alternativas para el tratamiento de las fluctuaciones motoras graves consisten en la administración de apomorfina subcutánea en infusión continua o de levodopa duodenal (Duodopa®), aunque esta última requiere la realización de una gastrostomía para permitir que la levodopa alcance directamente el duodeno evitando así el vaciamiento gástrico. Ambas formas de administración reducen de forma significativa las fluctuaciones motoras y, en menor grado, las discinesias.
Finalmente, cabe citar a la amantadina, un fármaco con actividad antiglutamatérgica, entre otras, que reduce de forma significativa la intensidad de las discinesias; sin embargo, puede producir edemas maleolares, confusión e insomnio. Debe administrarse con precaución en sujetos con insuficiencia renal.
Actualmente, el tratamiento farmacológico inicial de la enfermedad de Parkinson se fundamenta en la fisioterapia para reducir el deterioro del tono y la coordinación muscular y en el tratamiento de los síntomas motores cuando estos comienzan a afectar significativamente al estilo y calidad de la vida del paciente; adicionalmente, puede ser preciso actuar frente a otros síntomas asociados de naturaleza no motriz, mediante tratamientos específicos.
No hay un consenso generalizado sobre cuál es el mejor fármaco para iniciar el tratamiento, ni tampoco cuándo el momento preciso para realizarlo. Posiblemente, si los síntomas son leves, algunos expertos consideran que podría evitarse el tratamiento farmacológico durante las primeras fases de la enfermedad; en cualquier caso, esta decisión debe hacerse de forma individualizada, atendiendo a la gravedad de los síntomas, la afectación de la mano dominante, la presencia de bradicinesia y de trastornos de la marcha, la interferencia con las actividades laborales o de ocio, el riesgo de complicaciones motoras y neuropsiquiátricas e incluso – en no menor medida – las preferencias del paciente.
En general, la levodopa es el fármaco más eficaz en el control de los síntomas motores, por lo que puede utilizarse en monoterapia (siempre asociada a un inhibidor de la dopa descarboxilasa) en los estadios iniciales de la enfermedad; no obstante, muchos autores consideran que los agonistas dopaminérgicos son los fármacos de elección en monoterapia en el tratamiento inicial de los pacientes de inicio anterior a los 70 años, ya que producen menos complicaciones motoras (fluctuaciones y discinesias) que la levodopa, reservándose ésta como terapia inicial para los mayores de 70 años.
Los IMAO-B se emplean para el tratamiento complementario a una dosis estable de levodopa sola o en combinación con otros medicamentos antiparkinsonianos, en pacientes en fase media o avanzada con fluctuaciones. Igualmente, la administración de entacapona asociada a la levodopa proporciona un incremento del número de horas del estado on de 1- 1,5 horas.
Los agentes anticolinérgicos se consideran de segunda línea y pueden ser utilizados en monoterapia en pacientes menores de 70 años con temblor predominante sin deterioro cognitivo ni enfermedades neuropsiquiátricas; también pueden ser útiles cuando persiste el temblor tras el inicio de levodopa. Tampoco la amantadina es un fármaco de primera elección, pero puede usarse durante un periodo corto de tiempo en cuadros leves en pacientes en los que sea fundamental el control de la acinesia, la rigidez y el temblor.
ACCIÓN Y MECANISMO
La opicapona es un inhibidor periférico, de alta afinidad, reversible y selectivo de la catecol-O-metil transferasa (COMT). Cuando la levodopa se administra conjuntamente con un inhibidor periférico de la DOPA-descarboxilasa (carbidopa, benserazida), su principal vía metabólica periférica es precisamente la COMT, que transforma la levodopa en 3-O-metildopa. Ésta es capaz de competir con la levodopa en el sistema de transporte activo de la barrera hematoencefálica (astrocitos), reduciendo la penetración de levodopa en el sistema nervioso central y, con ello, su capacidad de transformarse en dopamina. Por consiguiente, la inhibición de la COMT a nivel periférica incrementa la disponibilidad de la levodopa en el sistema nervioso central; en concreto, se estima que la adición de opicapona al tratamiento con levodopa/inhibidor de la DOPA descarboxilada incrementa en torno a un 100% dicha disponibilidad, prolongando los efectos antiparkinsonianos de la levodopa en tanto que precursora de la dopamina, auténtica responsable del efecto antiparkinsoniano. Debido a la elevada afinidad de la opicapona por la COMT la velocidad de disociación de esta unión es baja, lo que permite mantener un efecto estable sobre los niveles plasmáticos de levodopa con una única dosis diaria de opicapona.
El medicamento ha sido autorizado oficialmente como terapia adyuvante a las preparaciones de levodopa/inhibidores de la DOPA descarboxilasa en pacientes adultos con enfermedad de Parkinson y fluctuaciones motoras de final de dosis que no puedan ser estabilizados con estas combinaciones.
ASPECTOS MOLECULARES
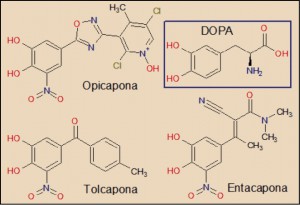
La opicapona es un inhibidor de la COMT, estructural y farmacológicamente relacionada con la tolcapona y la entacapona. En todos ellos destaca la presencia de un grupo nitro (-NO2), fuertemente desactivante, en el anillo catecólico (que recuerda la estructura de la DOPA), lo que se traduce en que la molécula se disocia de la COMT de forma mucho más lenta que la propia DOPA. En el caso de la opicapona, su pequeña constante de disociación le confiere un estatus de inhibidor reversible de larga duración del enzima.
EFICACIA Y SEGURIDAD CLÍNICAS
La eficacia y la seguridad clínicas de la opicapona han sido adecuadamente contrastadas en las indicaciones autorizadas mediante dos ensayos clínicos principales de fase 3 (confirmatorios de eficacia y seguridad), aleatorizados, multicéntricos, de brazos paralelos, doblemente ciegos y controlados con placebo y comparador activo (entacapona). Ambos fueron realizados con pacientes afectados por enfermedad de Parkinson que, pese a estar siendo tratados con levodopa y un inhibidor de la DOPA descarboxilasa (IDD: carbidopa o benserazida), presentaban fluctuaciones motoras de final de dosis. Cabe recordar que estas últimas, referidas habitualmente como fenómenos on-off, son una sucesión de respuestas de corta duración que aparecen con cada una de las dosis de levodopa y, en particular, la fase off se define como aquella durante la que se manifiesta lentitud (bradicinesia) o falta de movilidad (acinesia) relacionada con la finalización de la actividad de cada dosis de levodopa.
Los pacientes presentaban edades medias comprendidas entre los 61 y 65 años y su promedio diario de duración de las fases off era de 1,5 horas; todos estaban siendo tratados con una combinación de levodopa y un inhibidor de la DOPA descarboxilasa (IDD), con 3-8 dosis orales diarias. La duración de ambos estudios fue de 14-15 semanas (fase doblemente ciega), con extensión posterior (estudio abierto) hasta un año, en la que todos los pacientes recibieron opicapona. La variable principal de eficacia utilizada en ambos estudios consistió en la variación (reducción) media de la fase off desde el inicio del tratamiento con opicapona durante el periodo de estudio doblemente ciego (14-15 semanas) en relación al placebo y al comparador activo (entacapona). Dichos periodos fueron obtenidos a partir del registro diario de cada paciente.
En el primero de los estudios (Ferreira, 2015; BI-PARK 1) se asignó aleatoriamente a 600 pacientes, con edades comprendidas entre los 30 y 83 años, procedentes de 19 países europeos y de Rusia, para recibir dosis orales de 5, 25 o 50 mg/24 h, placebo o entacapona (200 mg conjuntamente con cada dosis de levodopa). Al final del periodo doblemente ciego (14-15 semanas), la variación media de la duración de la fase off fue de -56,0 minutos para el placebo, de -96,3 para entacapona, de -91,3 para la dosis de 5 mg/24 h de opicapona, de -85,9 para la de 25 mg y de -116,8 para la de 50 mg/24 h. En términos estadísticos, la dosis de 50 mg de opicapona fue superior al placebo (-60,8 min; IC95% -97,2 a -24,4; p=0,0015) y no inferior a la entacapona (-26,2 min; IC95% -63,8 a 11,4; p=0,0051). El tratamiento con las dosis de 5 (p=0,056) y 25 mg (p=0,080) de opicapona no fueron significativamente diferentes del placebo.
En el segundo de los estudios (Lees, 2017; BI-PARK 2) un grupo de 427 pacientes (60% varones; 63 años de promedio de edad) con características patológicas similares al estudio anterior, fueron aleatoriamente asignados a uno de los siguientes grupos de tratamiento: placebo, opicapona 25 mg/24 h y opicapona 50 mg/24 h; de estos, finalizaron 376 (88%), de los cuales 286 (76%) finalizaron la fase de extensión del estudio de un año de duración. Los resultados mostraron que, al final de la fase doblemente ciega (14-15 semanas), la variación media de la duración de la fase off fue de -64,5 min con placebo, 101,7 con opicapona 25 mg y -118,8 con opicapona 50 mg; las diferencias ajustadas frente a placebo fueron estadísticamente significativas para la dosis de 50 mg de opicapona (-54,3 min; IC95% -96,2 a -12,4; p=0,008), pero no con la de 25 mg (-37,2 min; IC95% -80,8 a 6,4; p=0,11). La reducción de la fase off se mantuvo a lo largo del año de duración de la fase abierta (-126,3 min).
Desde el punto de vista de la seguridad, la incidencia global de eventos adversos emergentes totales (50-55%) y severos (3,5-4,3%), fue similar a la observada con placebo. Lo más relevante es la incidencia de discinesia con ambas dosis de opicapona, con 7,6% (25 mg) y 15,7% (50 mg) vs. 8,2% con entacapona y 4,1% con placebo en el estudio BI-PARK-2, que aumenta hasta un 23,2% (25 mg) y 23,3% (50 mg) vs. 8,1% con placebo, en el BI-PARK-2. No obstante, en ambos estudios, la incidencia de discinesia se redujo sustancialmente con la continuación del tratamiento. El estreñimiento y el insomnio también fueron más frecuentes que el placebo, pero se encuentran en la misma línea que la entacapona. Los eventos adversos más comunes emergentes durante el tratamiento están descritos en la tabla 1.
|
Tabla 1. Incidencia (%) de eventos adversos emergentes durante |
||||
|
Evento adverso |
Placebo |
Entacapona |
Opicapona |
Opicapona |
|
Discinesia |
4,1-8,1 |
8,2 |
7,6-23,2 |
15,7-23,3 |
|
Estreñimiento |
1,5-2,5 |
4,1 |
0-9,6 |
6,1-6,7 |
|
Insomnio |
0,8-2,2 |
5,7 |
5,9-8,0 |
1,3-6,1 |
|
Sequedad de boca |
1,7 |
1,6 |
2,5-10,4 |
1,7-4,0 |
|
↑ Creatina fosfocinasa |
0-3,7 |
0,8 |
1,7-4,0 |
0,9-8,0 |
|
Hipertensión |
2,2-2,5 |
1,6 |
1,7-6,4 |
1,7-4,0 |
|
Vértigo |
0,8-1,5 |
4,1 |
3,2-5,0 |
2,6-4,0 |
|
Náusea |
1,7-5,9 |
6,6 |
2,5-6,4 |
2,6-3,3 |
|
Cefalea |
2,5-6,6 |
2,5 |
1,7-4,8 |
3,5-4,0 |
|
Infección urinaria |
0-1,5 |
1,6 |
0,8-2,4 |
0,9-6,0 |
ASPECTOS INNOVADORES
La opicapona es un inhibidor periférico, de alta afinidad, reversible y selectivo de la catecol-O-metil transferasa (COMT), análogo a la tolcapona y entacapona. Esta inhibición de la COMT a nivel periférico incrementa la disponibilidad de la levodopa en el sistema nervioso central, prolongando los efectos antiparkinsonianos de la levodopa. Debido a la elevada afinidad de la opicapona por la COMT la velocidad de disociación de esta unión es baja, lo que permite mantener un efecto estable sobre los niveles plasmáticos de levodopa con una única dosis diaria de opicapona. El medicamento ha sido autorizado oficialmente como terapia adyuvante a las preparaciones de levodopa/inhibidores de la DOPA descarboxilasa (carbidopa/benserazida) en pacientes adultos con enfermedad de Parkinson y fluctuaciones motoras de final de dosis que no puedan ser estabilizados con estas combinaciones.
Los datos clínicos obtenidos a partir de los dos ensayos clínicos de fase 3, controlados con placebo y (uno de ellos) con entacapona, muestran un efecto modesto pero clínicamente relevante sobre la duración de la fase off en los pacientes parkinsonianos tratados con levodopa/inhibidor de DOPA descarboxilasa que presentaban fluctuaciones motoras de final de dosis. En concreto, la dosis de 50 mg opicapona reduce la duración acumulada diaria en torno a 50-55 minutos más que el placebo y cerca de 25 minutos más que entacapona, aunque en este caso la diferencia no resultó ser estadísticamente significativa, mientras que las dosis de 5 y 25 mg de opicapona resultaron claramente inferiores a la de 50 mg, por lo que puede afirmarse, al menos, que la opicapona (50 mg) no es inferior a la entacapona (200 mg con cada dosis de levodopa).
Desde el punto de vista de la seguridad, el perfil es similar al de la entacapona, si bien la incidencia de discinesia es algo mayor, al menos durante las primeras fases del tratamiento. Esto sugiere que podría ser recomendable reducir la dosis de levodopa durante los primeros días o semanas del tratamiento con opicapona, con el fin de prevenir cuadros intensos de discinesia en los pacientes. No se ha observado ningún efecto que recuerde la hepatotoxicidad de la tolcapona2, su antecedente primario.
Así pues, nos encontramos con un inhibidor de la COMT comparable en eficacia y seguridad a la entacapona, aunque con la potencial ventaja de requerir una única administración oral diaria (la entacapona debe administrarse conjuntamente con cada dosis de levodopa/inhibidor de DOPA descarboxilasa). Sin embargo, esta supuesta ventaja es más teórica que práctica, dado que la dosificación de la levodopa/inhibidor de DOPA descarboxilasa no varía con la opicapona y, dado que actualmente hay disponibles formulaciones conjuntas de entacapona/levodopa/carbidopa (EFG, Stalevo®), no parece que la opicapona aporte ninguna novedad tampoco en este terreno.
|
VALORACIÓN |
|
OPICAPONA
|
|
Grupo Terapéutico (ATC): N04BX. SISTEMA NERVIOSO. Antiparkinsonianos: agentes dopaminérgicos: otros |
|
Indicaciones autorizadas: Terapia adyuvante a las preparaciones de levodopa/inhibidores de la DOPA descarboxilasa en pacientes adultos con enfermedad de Parkinson y fluctuaciones motoras de final de dosis que no puedan ser estabilizados con estas combinaciones. |
|
sin INNOVACIÓN. No implica aparentemente ninguna mejora farmacológica ni clínica en el tratamiento de las indicaciones autorizadas. |
|
FÁRMACOS RELACIONADOS REGISTRADOS EN ESPAÑA |
|||
|
Fármaco |
Medicamento® |
Laboratorio |
Año |
|
Tolcapona |
Tasmar |
Meda* |
1997** |
|
Entacapona |
Contam |
Novartis |
1999 |
|
Opicapona |
Ongentys |
Bial |
2017 |
* Transferido por Valeant en 2009 a Meda.
** Retirado por Farmacovigilancia (hepatotoxicidad) en 1998 y rehabilitado en 2005, como medicamento hospitalario.
BIBLIOGRAFÍA
Bibliografía
- Consejo General de Colegios Oficiales de Farmacéuticos. Bot PLUS WEB. https://botplusweb.portalfarma.com/
- Cuéllar Rodríguez S. Safinamida (Xadago®) en enfermedad de Parkinson. Panorama Actual Med 2016; 40(391): 211-7.
- Cuéllar Rodríguez S. Enfermedad de Parkinson. Panorama Actual Med. 2016; 40(392): 264-81.
- European Medicines Agency (EMA). Ongentys®. European Public Assessment Report (EPAR). EMA/320563/2016; EMEA/H/C/002790. http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_-_Public_assessment_report/human/002790/WC500209538.pdf
- Ferreira JJ, Lees A, Rocha JF, Poewe W, Rascol O, Soares-da-Silva P; Bi-Park 1 investigators. Opicapone as an adjunct to levodopa in patients with Parkinson’s disease and end-of-dose motor fluctuations: a randomised, double-blind, controlled trial. Lancet Neurol. 2015 Dec 22. pii: S1474-4422(15)00336-1. doi: 10.1016/S1474-4422(15)00336-1.
- Lees AJ, Ferreira J, Rascol O, Poewe W, Rocha JF, McCrory M, Soares-da-Silva P; BIPARK-2 Study Investigators. Opicapone as Adjunct to Levodopa Therapy in Patients With Parkinson Disease and Motor Fluctuations: A Randomized Clinical Trial. JAMA Neurol. 2017; 74(2): 197-206. doi: 10.1001/jamaneurol.2016.4703.
- Rodrigues FB, Ferreira JJ. Opicapone for the treatment of Parkinson’s disease. Expert Opin Pharmacother. 2017; 18(4): 445-53. doi: 10.1080/14656566.2017.1294683.
1 Pérdida o disminución del sentido del olfato. Puede ser temporal o permanente.
2 La tolcapona fue autorizada en España y otros países durante 1998, siendo posteriormente retirada en mismo año, debido a la detección de casos graves de hepatotoxicidad. Tras una revaluación de los datos de seguridad, fue rehabilitado el registro en 2005 aunque con una serie de restricciones de las condiciones de uso, prescripción y dispensación; actualmente es un medicamento de uso hospitalario (H).
Artículos relacionados
-
30 Dic 2024Medicamentos con nuevos principios activos o biosimilares Medicamentos con nuevos principios activos o biosimilares
-
2 Dic 2024Medicamentos con nuevos principios activos o biosimilares Medicamentos con nuevos principios activos o biosimilares
-
31 Oct 2024Medicamentos con nuevos principios activos o biosimilares Medicamentos con nuevos principios activos o biosimilares





