Pertuzumab PERJETA® (Roche)
 Nº375
Nº375
CÁNCER DE MAMA
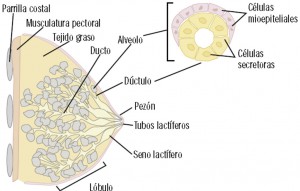
El cáncer de mama implica el crecimiento desenfrenado de células malignas en el tejido mamario con capacidad invasora y metastasizante. En el 99% de los casos, el cáncer de mama ocurre en mujeres, lo que implica que los varones son también susceptibles de padecer esta forma de cáncer aunque, obviamente, con carácter marginal. Los dos tipos principales de cáncer de mama son el carcinoma ductal (el más frecuente), que comienza en los conductos que llevan leche desde la mama hasta el pezón, y el carcinoma lobulillar que comienza en los lobulillos, que producen la leche materna (Martínez Jáñez, 2011).
El pronóstico y el tratamiento del cáncer de mama dependen, en gran medida, del estadio en el que se encuentre el tumor, que se basa en su tamaño y su extensión a los ganglios linfáticos regionales o a otras partes del cuerpo. El sistema TNM, atendiendo al tamaño el tumor (T), la afectación ganglionar (N) y la presencia o no de metástasis a distancia (M), permite estadificar la enfermedad en distintos estadios, entre I (local) y IV (metastásico).
El de mama es el cáncer más frecuente en las mujeres, diagnosticándose alrededor de 1,3 millones de nuevos casos cada año en todo el mundo y siendo responsable de 450.000 anualmente, de las cuales unas 80.000 acontecen en la Unión Europea. Por lo que respecta específicamente a España, los datos de 2012 indican un número total de 25.215 nuevos diagnósticos, lo que implica un 29% de todos los nuevos casos de cáncer en mujeres, con una tasa estandarizada por edad de 67,3 casos por 100.000 mujeres (SEOM, 2014). Según el Instituto Nacional de Estadística (INE, 2014), los últimos datos disponibles (correspondientes a 2012) indican que en España el de mama fue el tipo de cáncer con mayor mortalidad asociada en mujeres (6.282 fallecidas), por delante del de colon (4.831) y del de pulmón (3.826).
La incidencia en España es menor que la de Estados Unidos, Canadá, Reino Unido, Países Bajos, Bélgica, Alemania, Francia y Suiza, pero es similar a la de Portugal e Irlanda, así como de los países mediterráneos (Grecia, Italia, etc.) y el resto de los centroeuropeos. Se estima que el riesgo de padecer cáncer de mama a lo largo de la vida es de, aproximadamente, 1 de cada 8 mujeres. La mayoría de los casos se diagnostican en España entre los 35 y los 80 años, con un máximo entre los 45 y los 65. Existe una distribución geográfica de incidencia notablemente variable, siendo más elevada en Cataluña, con una tasa de incidencia de 84 casos/100.000 habitantes. Tanto el número de casos como las tasas de incidencia aumentan lentamente en España y en el mundo, probablemente debido al envejecimiento de la población y a un diagnóstico cada vez más precoz. La edad de máxima incidencia está por encima de los 50 años, pero aproximadamente un 6% se diagnostica en mujeres menores de 35 años. En Europa, el pronóstico es relativamente bueno, con una supervivencia media global a los 5 años del 77%. Adicionalmente, se han identificado los siguientes factores de riesgo para el cáncer de mama:
- Edad: el riesgo se incrementa al aumentar la edad. La mayoría de los casos ocurre en mujeres mayores de 50 años.
- Raza: es más frecuente en mujeres de raza blanca.
- Alcohol: su consumo excesivo aumenta el riesgo.
- Aparición temprana de la primera regla (menarquia).
- Menopausia tardía.
- Nivel económico medio-alto.
- Historia familiar: aumenta el riesgo si existe un familiar de primer grado (madre, hermana o hija) que haya padecido la enfermedad.
- Antecedentes personales: una mujer que haya tenido cáncer de mama tiene más riesgo de padecer otro cáncer en la mama contralateral.
- Enfermedades previas de la mama: algunas enfermedades de la mama como la hiperplasia atípica o el carcinoma lobulillar in situ pueden aumentar el riesgo.
- Primer embarazo tardío.
- Nuliparidad (ausencia de embarazo).
- Terapia hormonal sustitutiva prolongada: durante el tratamiento hormonal sustitutivo existe un mayor riesgo de carcinoma de mama, si bien depende de los tipos de preparados y se vuelve al riesgo habitual una vez que cesa el tratamiento.
En los estadios que pueden tratarse quirúrgicamente con éxito, los factores pronósticos marcan el riesgo que tiene una paciente de padecer una recaída de la enfermedad tras completar el tratamiento. La mayoría depende de las características anatomopatológicas del tumor, pero algunos dependen del propio paciente. Los dependientes del tumor más importantes son:
- Estadio clínico: tamaño tumoral y afectación ganglionar axilar. Ambos siguen considerándose el factor más importante, fundamentalmente la afectación axilar. La supervivencia después de 5 años tras el diagnóstico es prácticamente del 100% en el estadio I y del 18-23% en el esta-dio IV.
- Grado de diferenciación celular: cuanto menos diferenciado sea el tumor peor es su pronóstico.
- Receptores hormonales: las pacientes con tumores estrógenodependientes (células tumorales con presencia de receptores estrogénicos: ER+) se consideran de mejor pronóstico. Además, son sensibles al tratamiento hormonal, lo que amplía las opciones farmacológicas.
- Expresión de HER2: las pacientes con sobreexpresión de HER2 tienen peor pronóstico.
En cuanto a los relacionados con la paciente, el pronóstico es peor en pacientes menores de 35 años y premenopáusicas, así como en aquellas en que se identifique genéticamente la presencia de proteínas o factores de adhesión asociados a metástasis. En este sentido, la expresión excesiva de formas normales de receptores de factores de crecimiento es mucho más frecuente que las mutaciones de los protooncogenes que codifican su expresión. El ejemplo mejor conocido es el de los receptores de los factores de crecimiento epidérmico (HER: human epidermal growth factor receptor, o ErbB: eukaryotic ribosome biogenesis protein type B), de los que se conocen cuatro variantes: HER1 (ErbB-1, también conocido como EGFR o Epidermal Growth Factor Receptor), HER2 (ErbB-2), HER3 (ErbB-3) y HER4 (ErbB-4).
Los receptores de la familia HER se encuentran en la membrana celular y su sobreexpresión o sus anomalías y/o mutaciones están involucradas en el complicado proceso de carcinogénesis que incluye entre otras la proliferación celular incontrolada, la migración celular, invasión del estroma, la angiogénesis tumoral y resistencia a la apoptosis. Los HER están presentes en células de otros tumores sólidos; en este sentido, se detecta en el 40-80% de los cánceres no microcíticos de pulmón, en el 95-100% de los cánceres de útero, en el 40-50% de los cánceres renales, en el 25-80% de los tumores colorrectales y en el 20-25% de los cánceres invasivos de mama, en este caso, específicamente como HER21 (Tolaney, 2014) y en algunas neoplasias de ovario, de pulmón, de estómago, de colon y de glándulas salivales. Concretamente, en el cáncer de mama parece existir una clara relación entre la sobreexpresión de HER2 y la invasión, las metástasis a distancia, el desarrollo de resistencia tumoral a determinados antineoplásicos, el fenotipo agresivo, las mutaciones en p53 y los estadios avanzados de la enfermedad.
El tratamiento del cáncer de mama precisa la combinación de diversas modalidades terapéuticas para conseguir un control eficaz de la enfermedad. Estas modalidades son la cirugía, la radioterapia, la quimioterapia, la hormonoterapia y la terapia biológica. Las dos primeras actúan a nivel local, es decir, sobre la enfermedad en la mama y los ganglios linfáticos, y constituyen el tratamiento de elección en la enfermedad localizada no metastásica. Las restantes actúan tanto a nivel local como general en todo el organismo, en lo que se denomina tratamiento sistémico, y se utilizan de forma complementaria al tratamiento local con cirugía y/o radioterapia o como tratamiento de primera elección en la enfermedad metastásica o diseminada (Martínez Jáñez, 2011).
La quimioterapia neoadyuvante – la que se administra antes de la cirugía – está indicada en los cánceres de mama localmente avanzados y en aquellos que midan más de 2 cm o que tengan adenopatías axilares. Los fármacos más utilizados son las antraciclinas y los taxanos, en combinación con otros agentes (ciclofosfamida, fluorouracilo, carboplatino, etc.). La intención de este tratamiento en los casos de tumores operables consiste en conseguir la disminución del tamaño tumoral para practicar una cirugía conservadora, con preservación de la mama, y la valoración de la respuesta a la quimioterapia para posteriores tratamientos; y, en el caso de los tumores localmente avanzados e inflamatorios, no operables de inicio, se busca reducir el volumen tumoral para poder realizar una cirugía – que no será ya conservadora –, con márgenes libres de enfermedad.
Por su parte, la indicación de la quimioterapia adyuvante – la que se administra después de la cirugía – depende de los factores pronósticos clásicos, que son la edad, el tamaño tumoral, la afectación ganglionar axilar, el grado de diferenciación celular (grado histológico) y los receptores hormonales presentes. Actualmente se dispone de test bioquímicos que permiten valorar el grado de agresividad el tumor, basándose no sólo en factores clásicos como el grado de diferenciación o el tamaño, sino también en la presencia o no de varios genes con capacidad de inducir metástasis. Con la determinación del perfil genético, se puede definir mejor la probabilidad de recidiva a distancia y pautar un tratamiento más personalizado (en pacientes de bajo riesgo, hormonoterapia y, en los de alto riesgo, quimioterapia).
La quimioterapia utilizada depende del riesgo de recaída, pero en un 80% se utilizan taxanos y antraciclinas, evitando los taxanos en aquellos casos con tumores menores de 2 cm (grado I), sin afectación ganglionar y posmenopáusicas, ya que su utilización no ha demostrado mejoría en la supervivencia libre de progresión tumoral. Un metaanálisis (Bria, 2006) englobando estudios en los que se emplearon esquemas de quimioterapia como el clásico CMF (ciclofosfamida, metotrexato y fluorouracilo) y esquemas basados en antraciclinas, como FAC (fluorouracilo, doxorubicina y ciclofosfamida) o FEC (fluorouracilo, epirubicina y ciclofosfamida), pero sin incluir los taxanos ni el trastuzumab, demostró que la quimioterapia adyuvante de 6 meses de duración con esquemas basados en antraciclinas, como FEC y FAC, reduce el riesgo anual de muerte por cáncer de mama en un 38% en las mujeres menores de 50 años y en casi el 20% en mujeres con edades comprendidas entre los 50 y 69 años, con in-dependencia del uso de tamoxifeno, el estado de los receptores hormonales, la afectación de los ganglios axilares u otras características del tumor. Además, este metaanálisis demostró que los esquemas con antraci-clinas disminuyen significativamente tanto la probabi-lidad de recidiva como el riesgo de muerte por cáncer, cuando se comparan con el esquema clásico de CMF.
Los pacientes que presentan metástasis ganglionares regionales (axilares) tienen un mayor riesgo de recidiva, sobre todo si hay afectación de 4 o más ganglios. En estos casos, la asociación de los taxanos (docetaxel o paclitaxel), generalmente, a los esquemas de quimioterapia con antraciclinas mejora claramente la supervivencia libre de enfermedad y la supervivencia global. En las pacientes con tumores que sobreexpresan la proteína HER2, se debe asociar al tratamiento el anticuerpo monoclonal específico frente el receptor HER2: trastuzumab. La asociación de éste con la quimioterapia adyuvante reduce alrededor de un 50% el riesgo de recaída en pacientes operadas de cáncer.
El cáncer de mama metastásico de inicio (en el momento del diagnóstico) se observa en un 5-10% de los casos y en el seguimiento de las pacientes diagnosticadas previamente de enfermedad local, se observa metástasis en el 50%. Los objetivos del tratamiento paliativo del cáncer metastásico son lograr un alivio sintomático y proporcionar una atención emocional, social y espiritual para el enfermo y la familia, utilizando un tratamiento oncoespecífico (quimioterapia, hormonoterapia, radioterapia) que haya demostrado, en un análisis de riesgo-costo-beneficio previo, la conveniencia de su utilización.
La quimioterapia antitumoral ha mostrado beneficio en el incremento de la supervivencia y de la calidad de vida en las pacientes con cáncer de mama, pero no siempre está indicada. La elección de la quimioterapia en cada paciente depende varios factores: si recibieron quimioterapia adyuvante y la recaída tiene lugar en menos de 1 año, no se vuelve a utilizar el régimen empleado en la adyuvancia; si la localización es crítica y la carga tumoral importante, se necesitan esquemas rápidamente activos y generalmente más tóxicos; la edad y la comorbilidad también son factores que se tienen en cuenta a la hora de elegir un tratamiento.
Las pacientes con sobreexpresión HER2 son candidatas a recibir tratamiento anti-HER2 asociado a la quimioterapia. Hasta ahora había disponibles 3 fármacos: el trastuzumab, un anticuerpo monoclonal frente a este receptor, y el lapatinib, que inhibe su actividad tirosina cinasa, y el bevacizumab, un anticuerpo antiangiogénico que bloquea la formación la neovasculatura tumoral. La combinación de alguno de ellos – en particular, el trastuzumab – con quimioterapia (paclitaxel, docetaxel o capecitabina) mejora significativamente las tasas de respuesta y el tiempo a la progresión, con tasas de respuestas que en algunos casos llegan al 70%, con una supervivencia libre de progresión tumoral de 11-12 meses y una supervivencia global de 24-36 meses.
ACCIÓN Y MECANISMO
El pertuzumab es un anticuerpo monoclonal humanizado recombinante dirigido contra el dominio de dimerización extracelular (subdominio II) de la proteína 2 del receptor de crecimiento epidérmico (HER2), lo que bloquea la formación de heterodímeros de HER2 con otros miembros de la familia HER activados por sus ligandos. Este bloqueo impide la señalización intracelular iniciada por el ligando, a través de dos vías diferentes: la proteína cinasa activada por mitógenos (MAP) y la fosfoinosito 3-cinasa (PI3K), lo que se traduce en un bloqueo del crecimiento y de la apoptosis celular, respectivamente. Además, el pertuzumab activa la citotoxicidad celular dependiente de anticuerpos, como lo hace también el trastuzumab.
En contraste con el pertuzumab, el trastuzumab se une al subdominio IV del dominio extracelular de HER2 y altera las interacciones independientes de los ligandos, pero no es eficaz en el bloqueo de la heterodimerización de HER2 con otros miembros de la familia HER activados por ligandos (EGFR, HER3 o HER4). Además, el trastuzumab, mediante la unión al dominio IV, bloquea el sitio de escisión proteolítica del ectodominio de HER2 y la generación resultante de p95 fosforilada y la activación constitutiva de los dominios intracelulares de cinasa, mientras que el pertuzumab no comparte esta actividad con trastuzumab. Así pues, trastuzumab y pertuzumab presentan acciones complementarias sobre el HER2
El HER2 forma parte de la familia de los receptores de los factores de crecimiento epidérmico HER o ErbB, presentes en la membrana celular y cuya sobreexpresión y/o el desarrollo de mutaciones están involucradas en el proceso de carcinogénesis, incluyendo entre otras la proliferación celular incontrolada, la migración celular, invasión del estroma, la angiogénesis tumoral y resistencia a la apoptosis. La expresión del HER2 está amplificada en el 20-25% de los pacientes con carcinoma de mama invasivo y en porcentajes variables de neoplasias de ovario, pulmón, estómago, colon y glándulas salivales. Concretamente, en el cáncer de mama parece existir una clara relación entre la sobreexpresión de HER2 y la invasión, las metástasis a distancia, el fenotipo agresivo, las mutaciones en p53 y los estadios avanzados de la enfermedad.
El pertuzumab ha sido autorizado para el tratamiento en combinación con trastuzumab y docetaxel para el tratamiento de pacientes adultos con cáncer de mama HER2 positivo localmente recidivante irresecable o metastásico, que no han recibido tratamiento previo anti-HER2 o quimioterapia para la enfermedad metastásica.
EFICACIA Y SEGURIDAD CLÍNICAS
La eficacia y la seguridad clínicas del pertuzumab han sido adecuadamente contrastadas mediante un ensayo clínico principal de fase III (CLEOPATRA: Clinical Evaluation of Pertuzumab and Trastuzumab; Baselga, 2010), aleatorizado, doblemente ciego, multicéntrico (250), multinacional y controlado con placebo, realizado sobre 808 pacientes con adenocarcinoma de mama localmente recurrente o con enfermedad metastásica, confirmado histológica o citológicamente y HER2-positivos. Todos los pacientes recibieron trastuzumab (infusión IV: 8 mg/kg la primera vez y 6 mg/kg las siguientes dosis) y docetaxel2 (infusión IV: 75 mg/m2) cada tres semanas; adicionalmente, la mitad aproximadamente recibieron pertuzumab (infusión IV: 840 mg la primera vez y 420 mg las siguientes) o placebo, también en ciclos de tres semanas, coincidiendo con el tratamiento común. El tratamiento se mantuvo durante un mínimo de seis ciclos o hasta la progresión tumoral, toxicidad inaceptable o retirada del consentimiento del paciente. El 91% de las pacientes eran no fumadoras o exfumadoras, con 54 años de mediana de edad (16% mayores de 65 años), 59% caucásicas 32% asiáticas, 54% no pretratadas y 10% pretratadas (al menos un año antes) con trastuzumab.
Como variable principal de eficacia se determinó la supervivencia libre de progresión tumoral (mediana del tiempo transcurrido desde la primera dosis hasta progresión tumoral constatada o muerte), determinada por un comité independiente; como variables secundarias se estableció este mismo parámetro, pero determinado por los investigadores. Asimismo, otras variables secundarias de eficacia fueron la supervivencia global, la tasa de respuesta objetiva (respuestas parciales y completas), duración de la respuesta antitumoral, tiempo hasta la progresión de los síntomas, variables de calidad de vida, etc.
Los resultados mostraron que la mediana de supervivencia libre de progresión tumoral calculada por un comité independiente fue de 18,5 meses (IC95% 15 a 23) con pertuzumab vs. 12,4 (10-13) con placebo (HR: 0,62; IC95% 0,51 a 0,75; p< 0,0001), siendo la tasa de supervivencia libre de enfermedad a un año del 65% (60-70) vs. 51% (46-56). Al estratificar la muestra por diferentes conceptos (edad, región geográfica, raza, localización de las metástasis, etc.), las diferencias encontradas fueron también estadísticamente significativas entre peretuzumab y placebo, salvo para pacientes mayores de 75 años, raza negra y metástasis no viscerales.
En cuanto a las variables secundarias, la supervivencia libre de progresión tumoral calculada por los investigadores fue de 18,7 meses 7 vs. 12,4 7 (HR: 0,69; IC95% 0,58 a 0,81; p< 0,0001). Por su parte, la supervivencia global con placebo fue de 37,6 meses pero no pudo estimarse la correspondiente al pertuzumab, aunque al cabo de 30 meses de seguimiento la mortalidad en el grupo del pertuzumab fue del 28,1% vs. 37,9% con placebo 18,5 meses (HR: 0,66; IC95% 0,52 a 0,84; p= 0,0008), siendo la tasa de supervivencia libre de enfermedad a un año del 65% (60-70) vs. 51% (46-56). En cuanto a la tasa de respuesta objetiva, ésta fue del 80,2% (IC95% 75,6 a 84,3) vs. 69,3% (IC95% 64,1 a 74,2), mientras que la duración mediana de la respuesta antitumoral fue de 87,6 semanas (IC95% 71 a 106) vs. 54,1 (IC95% 46 a 64).
En cuanto a la progresión de los síntomas, el tiempo transcurrido hasta una reducción de al menos 5 puntos en la escala TOI-PFB (Trial Outcome Index-Physical/Functional Breast) del cuestionario FACT-B (Functional Assessment of Cancer Therapy-Breast) fue de 18,4 semanas vs. 18,3 (seis ciclos, aproximadamente); asimismo, la mediana de tiempo transcurrida hasta experimentar un incremento de al menos dos puntos en la subescala BCS (Breast Cancer Subescale) fue de 26,7 semanas vs. 18,3 (HR: 0,77; p= 0,0061) (Cortés, 2013).
Desde el punto de vista de la seguridad, el perfil del pertuzumab está en línea con el del trastuzumab, aunque la adición de pertuzumab supone un aumento de la incidencia de eventos adversos (considerando que ambos se utilizan conjuntamente con docetaxel). Los más frecuentes (>10%) y más comunes con pertuzumab que con placebo (diferencia de al menos 2 puntos porcentuales, mayor con pertuzumab) fueron en los ensayos clínicos: diarrea (67% con pertuzumab vs. 46% con placebo), neutropenia (53/50%), exantema (34/24%), anorexia (29/26%), mucositis (28/20%), anemia (23/19%), cefalea (21/17%), estomatitis (19/15%), infecciones en el tracto respiratorio superior (17/13%), dolor en las extremidades (15/12%), prurito (14/10%), neutropenia febril (4/8%) y sequedad de piel (11/4%).
La incidencia de eventos adversos graves fue del 34% vs. 26%, particularmente para la neutropenia febril (11,3% vs. 5,0%) y la diarrea (2,7% vs. 1,3%). La descontinuación del tratamiento motivada por eventos adversos fue del 6,1% vs. 5,3% (excluyendo aquellas debidas a eventos adversos asociados al docetaxel).
ASPECTOS INNOVADORES
El pertuzumab es un anticuerpo monoclonal humanizado recombinante dirigido contra el dominio de dimerización extracelular (subdominio II) de la proteína 2 del receptor de crecimiento epidérmico (HER2), lo que bloquea la formación de heterodímeros de HER2 con otros miembros de la familia HER activados por sus ligandos. En contraste con el pertuzumab, el trastuzumab se une al subdominio IV del dominio extracelular de HER2 y altera las interacciones independientes de los ligandos, pero no es eficaz en el bloqueo de la heterodimerización de HER2 con otros miembros de la familia HER (ErbB) activados por ligandos (EGFR, HER3 o HER4). El pertuzumab ha sido autorizado para el tratamiento en combinación con trastuzumab y docetaxel para el tratamiento de pacientes adultos con cáncer de mama HER2 positivo localmente recidivante irresecable o metastásico, que no han recibido tratamiento previo anti-HER2 o quimioterapia para la enfermedad metastásica.
Los datos procedentes del ensayo clínico pivotal son robustos y muy consistentes, tanto clínica como estadísticamente, mostrando que el pertuzumab incrementa en 6,1 meses la duración de la supervivencia libre de progresión tumoral, con una reducción de la tasa de mortalidad a los 30 meses de casi 10 puntos porcentuales (28,1% vs. 37,9%). Los resultados fueron relevantes considerando diferentes aspectos de los pacientes y lo fueron particularmente en pacientes mayores de 65 años (HR: 0,65 en <65 años y 0,52 en ≥65 años) (Miler, 2013), aunque no ocurrió así en los mayores de 75 años (posiblemente, por el pequeño número de pacientes con esta edad). Por otro lado, los pacientes con metástasis no viscerales no obtuvieron ningún beneficio adicional con pertuzumab aunque, como en el caso anterior, la ausencia de diferencias significativas podría estar relacionadas con el bajo número de pacientes estudiados.
Aunque se ha alegado que menos de la mitad de los pacientes incluidos en el estudio pivotal habían sido pretratados y que solo un 10% habían recibido con anterioridad trastuzumab, lo cual no parece representar genuinamente la población susceptible de beneficiarse con el nuevo tratamiento, esto se justifica por la no disponibilidad generalizada del trastuzumab en el momento de comenzar el estudio y por la propia consistencia de los datos obtenido en el mismo (EMA, 2013).
El perfil de toxicidad del pertuzumab parece estar en la misma línea que el del trastuzumab, aunque su adición a ésta incrementa la incidencia (y en algunos casos, la gravedad) de diarrea, exantema, estomatitis, mucositis y neutropenia; no obstante, la mayoría de ellos fueron clínicamente manejable y, de hecho, la tasa de suspensión del tratamiento por eventos adversos no fue sustancialmente diferente de la rama placebo (6,1 vs. 5,3%). Otro aspecto relevante es que no se ha observado ningún incremento de la cardiotoxicidad (manifestada principalmente como insuficiencia cardiaca), un fenómeno que se ha asociado al bloqueo de los receptores de la familia HER.
Según el Informe de Posicionamiento Terapéutico (IPT) de la AEMPS, los pacientes candidatos a tratamiento con pertuzumab, en combinación con trastuzumab y docetaxel, serán aquellos diagnosticados de cáncer de mama con una recaída local, irresecable o metastásico, HER2 positivo, que no hayan recibido tratamiento previo anti-HER2 o quimioterapia para la enfermedad metastásica, con buen estado general y con función cardiaca normal. Los pacientes podrían haber recibido hormonoterapia para la enfermedad metastásica o cualquier tratamiento sistémico (incluido trastuzumab) como neoadyuvancia o adyuvancia durante la fase terapéutica de la enfermedad precoz, siempre que la recaída se produzca a partir de los 12 meses de finalización de la adyuvancia. Sin embargo, parece razonable que pacientes que recaigan a tratamiento previo en (neo)adyuvancia (incluido el tratamiento con trastuzumab) entre el mes 6 y 12 también puedan beneficiarse de pertuzumab. En caso de contraindicación para la utilización de docetaxel, sería razonable la utilización de pertuzumab con trastuzumab y paclitaxel semanal (AEMPS, 2014).
Los tumores HER2 positivos representan aproximadamente el 20% de todos los cánceres de mama y, además, confieren a estos un comportamiento más agresivo y, por tanto, empeoran el pronóstico general. Por consiguiente, la acción selectiva del trastuzumab vino a revolucionar el tratamiento y, de hecho, se ha convertido en un estándar para este tipo de tumores (Harbeck, 2013; Lamond, 2014). Aunque está farmacológicamente relacionado con el trastuzumab, el pertuzumab presenta un mecanismo parcialmente diferente, lo que permite complementar – y ampliar – el bloqueo de la vía de señalización tumoral HER. En este sentido, el pertuzumab impide la formación de heterodímeros con otros miembros de la familia (HER1 o EGFR, HER3 y HER4), amplificando los efectos del trastuzumab (Thery, 2014).
En definitiva, el pertuzumab supone una relevante incorporación para el tratamiento del cáncer de mama HER2 positivo, al incrementar significativamente la supervivencia de los pacientes ampliando el perfil farmacológico del trastuzumab, todo ello con un perfil de seguridad aceptable.
BIBLIOGRAFIA
- Agencia Española de Medicamentos y Productos Sanitarios (AEMPS). Informe de Posicionamiento Terapéutico de Pertuzumab (Perjeta®). http://www.aemps.gob.es/medicamentosUsoHumano/informesPublicos/docs/IPT-Pertuzumab-perjeta-aprobado-GCPT.pdf (Fecha de publicación: 17 de junio de 2014)
- Baselga J, Swain SM. CLEOPATRA: a phase III evaluation of pertuzumab and trastuzumab for HER2-positive metastatic breast cancer. Clin Breast Cancer. 2010; 10(6): 489-91. doi: 10.3816/CBC.2010.n.065.
- Bria E, Nistico C, Cuppone F, Carlini P, Ciccarese M, Milella M, et al. Benefit of taxanes as adjuvant chemotherapy for early breast cancer: pooled analysis of 15,500 patients. Cancer 2006; 106 (11): 2337-44.
- Consejo General de Colegios Oficiales de Farmacéuticos. Bot PLUS WEB. https://botplusweb.portalfarma.com/
- Cortés J, Baselga J, Im YH, Im SA, Pivot X, Ross G, Clark E, Knott A, Swain SM. Health-related quality-of-life assessment in CLEOPATRA, a phase III study combining pertuzumab with trastuzumab and docetaxel in metastatic breast cancer. Ann Oncol. 2013; 24(10): 2630-5. doi: 10.1093/annonc/mdt274.
- European Medicines Agency (EMA). Perjeta®. European Public Assessment Report (EPAR). EMA/824939/2013; EMEA/H/C/002547. http://www.ema.europa.eu/.
- Harbeck N, Wuerstlein R. Optimal sequencing of anti-HER2 therapy throughout the continuum of HER2-positive breast cancer: evidence and clinical considerations. Drugs. 2013; 73(15): 1665-80. doi: 10.1007/s40265-013-0118-z.
- Instituto Nacional de Estadística (INE). Defunciones según la causa de muerte (2012). http://www.ine.es/prensa/np830.pdf
- Lamond NW, Younis T. Pertuzumab in human epidermal growth-factor receptor 2-positive breast cancer: clinical and economic considerations. Int J Womens Health. 2014; 6: 509-521.
- Martínez Jáñez N, Guerra Alía EM, Crespo Massieu C, Carrato Mena A. Terapéutica farmacológica de los tumores ginecológicos. En: Terapéutica farmacológica de los trastornos neoplásicos e inmunológicos. Consejo General de Colegios Oficiales de Farmacéuticos. Madrid; 2011. p. 221-44.
- Miles D, Baselga J, Amadori D, Sunpaweravong P, Semiglazov V, Knott A, Clark E, Ross G, Swain SM. Treatment of older patients with HER2-positive metastatic breast cancer with pertuzumab, trastuzumab, and docetaxel: subgroup analyses from a randomized, double-blind, placebo-controlled phase III trial (CLEOPATRA). Breast Cancer Res Treat. 2013; 142: 89-99. doi: 10.1007/s10549-013-2710-z.
- Sociedad Española de Oncología Médica (SEOM). El cáncer en España 2014. http://www.seom.org/es/prensa/el-cancer-en-espanyacom/104582-el-cancer-en-espana-2014?start=5#content (27 de enero de 2014)
- Swain SM, Kim SB, Cortés J, Ro J, Semiglazov V, Campone M, Ciruelos E, Ferrero JM, Schneeweiss A, Knott A, Clark E, Ross G, Benyunes MC, Baselga J. Pertuzumab, trastuzumab, and docetaxel for HER2-positive metastatic breast cancer (CLEOPATRA study): overall survival results from a randomised, double-blind, placebo-controlled, phase 3 study. Lancet Oncol. 2013; 14(6): 461-71. doi: 10.1016/S1470-2045(13)70130-X.
- Thery JC, Spano JP, Azria D, Raymond E, Penault Llorca F. Resistance to human epidermal growth factor receptor type 2-targeted therapies. Eur J Cancer. 2014; 50(5): 892-901. doi: 10.1016/j.ejca.2014.01.003.
- Tolaney S. New HER2-positive targeting agents in clinical practice. Curr Oncol Rep. 2014; 16: 359. doi: 10.1007/s11912-013-0359-8.
| VALORACIÓN | |
|---|---|
| PERTUZUMAB PERJETA®(Roche) | |
| Grupo Terapéutico (ATC): L01XE. TERAPIA ANTINEOPLÁSICA Y AGENTES INMUNOMODULADORES. Cistostáticos: anticuerpos monoclonales. | |
| Indicaciones autorizadas: Tratamiento en combinación con trastuzumab y docetaxel para el tratamiento de pacientes adultos con cáncer de mama HER2 positivo localmente recidivante irresecable o metastásico, que no han recibido tratamiento previo anti-HER2 o quimioterapia para la enfermedad metastásica. | |
| VALORACIÓN GLOBAL: INNOVACIÓN importante. Aportación sustancial a la terapéutica estándar. | ♣ ♣ ♣ |
| Novedad clínica: Mejora de forma relevante la eficacia clínica del tratamiento farmacológico estándar | ⇑ |
| Novedad molecular: Incorpora un mecanismo de acción complementario con medicamentos actualmente utilizados. | ⇑ |
| FÁRMACOS RELACIONADOS REGISTRADOS ANTERIORMENTE EN ESPAÑA | |||
|---|---|---|---|
| Fármaco | Medicamento® | Laboratorio | Año |
| Fármaco | Medicamento® | Laboratorio | Año |
| Rituximab | Mabthera | Roche | 1998 |
| Trastuzumab | Herceptin | Roche | 2000 |
| Bevacizumab | Avastin | Roche | 2005 |
| Panitumumab | Vectibix | Amgen | 2007 |
| Cetuximab | Erbitux | Merck | 2007 |
| Ipilimumab | Yervoy | Bristol Myers Squibb | 2011 |
| Pertuzumab | Perjeta | Roche | 2014 |
1. El receptor del factor de crecimiento epidérmico de tipo 2 (HER2) es una proteína de membrana que desempeña un papel clave en el crecimiento y desarrollo de las células epiteliales. Su dominio extracelular (ECD, p105) puede liberarse en el torrente sanguíneo y ser medido en muestras de suero. El gen responsable está localizado en la región 17q21.1, en el brazo grande del cromosoma 17; codifica para una glucoproteína con actividad tirosina cinasa en su dominio intracitosólico.
2. Con posibilidad de incrementar la dosis de docetaxel a 100 mg/m2 si la toxicidad lo permitía.
Artículos relacionados
-
31 Oct 2024Medicamentos con nuevos principios activos o biosimilares Medicamentos con nuevos principios activos o biosimilares
-
7 Oct 2024Medicamentos con nuevos principios activos o biosimilares Medicamentos con nuevos principios activos o biosimilares
-
6 Ago 2024Medicamentos con nuevos principios activos o biosimilares Medicamentos con nuevos principios activos o biosimilares