Vandetanib CAPRELSA® (AstraZeneca)
 Nº380
Nº380
Resumen
El vandetanib es un inhibidor de tirosina cinasas, particularmente VEGFR-2, VEGFR-3, EGFR y RET; ha sido autorizado para el tratamiento del cáncer medular de tiroides agresivo y sintomático en pacientes con enfermedad irresecable localmente avanzada o metastásica. Incrementa de forma significativa la duración de la supervivencia libre de progresión tumoral (mediana de 30,5 vs. 19,3 meses); sin embargo, no se ha podido confirmar hasta ahora un efecto sobre la supervivencia global. El medicamento presenta un perfil toxicológico importante, destacando la diarrea y, en particular, el alargamiento del segmento QT del electrocardiograma, un signo de riesgo de graves arritmias cardiacas (especialmente, torsades de pointes). El IPT recomienda el empleo de vandetanib en pacientes con cáncer medular de tiroides agresivo y sintomático con enfermedad metastásica, en los que exista evidencia radiológica de una franca progresión tumoral, así como una clara sintomatología clínica asociada a la enfermedad; también en aquellos en los que las lesiones no sean evaluables radiológicamente y que presenten un tiempo de duplicación de CTN o CEA menor de 24 meses; igualmente, en los pacientes con enfermedad locorregional no controlada y claramente sintomática, tras cirugía y/o tratamiento con radioterapia (incluso en ausencia de metástasis).
CÁNCER MEDULAR DE TIROIDES
Los tumores malignos de tiroides son los más frecuentes y los que mayor mortalidad ocasionan del sistema endocrino; aun así solo son responsables del 1% de los fallecimientos producidos por cáncer. Tradicionalmente, los tumores malignos1 epiteliales primarios o carcinomas de tiroides se clasifican según el tipo celular en carcinomas de células foliculares, de células parafoliculares C y mixtos. Los carcinomas de células foliculares pueden ser diferenciados (papilar y folicular), poco diferenciados (insular y otros) o indiferenciados (anaplásico), mientras que el único tipo de carcinoma de células parafoliculares (células C) es el cáncer medular. Adicionalmente, hay cánceres tiroideos constituidos por poblaciones celulares tumorales mixtas. Desde el punto de vista epidemiológico, la denominación de cáncer de tiroides incluye a todos los tumores derivados de células tiroideas, quedando por tanto excluidos los linfomas y los sarcomas que asientan en esta glándula. Más del 90% de las neoplasias tiroideas corresponden a tumores bien diferenciados (Bos, 2012).
La incidencia de cáncer de tiroides es considerablemente más elevada en mujeres que en varones. Sin embargo, la distribución por edad es semejante en ambos sexos; a partir de los 10-15 años, la incidencia comienza a aumentar (de forma más pronunciada en mujeres) hasta alcanzar un máximo en torno a los 60 años en mujeres y los 55 en varones, con unas tasas de, aproximadamente, 11 y 5 casos por 100.000 en mujeres y varones, respectivamente. A partir de esa edad la incidencia comienza a descender progresivamente. En España las tasas de incidencia oscilan entre el 3,6% y 4,9% en mujeres y el 0,6 y 1,3% en varones. Su incidencia a lo largo de las últimas décadas ha ido aumentando (Lope, 2005).
La exposición a radiación ionizante es el factor de riesgo mejor evidenciado en el cáncer de tiroides. Dicha glándula es uno de los órganos más radiosensibles del organismo, debido a su localización superficial, a su alto grado de oxigenación y a su alta tasa de división celular. El carcinoma papilar es el principal tipo celular inducido por radiación. Las principales fuentes de exposición son la irradiación terapéutica y la contaminación ambiental por accidentes industriales o detonaciones nucleares.
El bocio multinodular endémico asociado a un contenido inadecuado de iodo en la dieta que se presenta en ciertas áreas geográficas con suelos pobres en iodo (normalmente alejados de zonas costeras) parecen estar asociado con un alto riesgo de carcinoma folicular y posiblemente también de anaplásico, mientras que las áreas ricas en iodo tienden a presentar un aumento del riesgo de carcinoma papilar.
Hay abundantes datos que demuestran la marcada asociación entre la presencia de nódulos tiroideos benignos (adenomas) y bocio con el cáncer de tiroides. Esta asociación podría reflejar la existencia de diversas situaciones como una posible relación causal, una lesión precursora, el efecto de un tratamiento, o bien ser factores de riesgo independientes. Sin embargo, existe una discordancia importante en lo concerniente a la asociación entre tiroiditis de Hashimoto y el cáncer de tioides; igualmente, el papel de la tirotoxicosis en la etiología de este tipo de tumor permanece incierto. En relación con otras enfermedades no tiroideas, en algunos estudios se ha observado un exceso de carcinomas tiroideos entre pacientes con cáncer de mama, y viceversa; también, aunque en menor medida, se ha encontrado una asociación con otras neoplasias, hiperparatiroidismo, anemia aplásica, acromegalia y ataxia telangiectásica.
El hecho de que la incidencia del cáncer de tiroides sea de 2 a 3 veces mayor en mujeres que en varones, fundamentalmente durante su edad reproductiva, unido al cambio de tamaño y de actividad que sufre la glándula durante el ciclo menstrual, sugiere que las hormonas femeninas pueden desempeñar un papel importante en la etiología de este tumor. Concentraciones elevadas de la TSH están asociadas con un mayor riesgo de padecer cáncer de tiroides, y la tasa de secreción de esta hormona se eleva durante la pubertad, el embarazo, el parto, el uso de anticonceptivos orales, la tiroidectomía parcial, el consumo de productos bociógenos y la radiación del cuello. Sin embargo, no parece que exista una asociación clara entre el cáncer de tiroides y los factores menstruales y reproductivos, aunque algunos estudios han sugerido un exceso de riesgo de cáncer papilar asociado con el uso de anticonceptivos orales, principalmente entre usuarias habituales. Se han descrito también como posibles factores de riesgo los tratamientos para suprimir la lactancia y los tratamientos fertilizantes, el tratamiento hormonal posmenopáusico y el embarazo a edades tardías. Igualmente se ha comunicado un aumento de riesgo en los primeros años tras el parto, pero no se ha encontrado asociación con historia previa de abortos, infertilidad ni paridad.
El cáncer papilar de tiroides supone más del 70% de los tumores tiroideos y es el de mejor pronóstico (90% supervivencia a los 10 años). Es más frecuente en mujeres (3:1), en la cuarta década de la vida. Se suele presentar como un nódulo único, indoloro, con adenopatías también indoloras y de lento crecimiento. Metastatiza vía linfática y de forma precoz en la cadena ganglionar cervical pero sólo se aprecian metástasis a distancia si está muy avanzado puesto que su diseminación hematógena es rara. Histológicamente es un tumor multicéntrico (20%), bien diferenciado, que deriva de células foliculares, no encapsulado y con calcificaciones que forman los típicos cuerpos de psamoma.
Por su parte, el cáncer folicular supone el 10-15% de los tumores tiroideos. Es también más frecuente en mujeres (3:1), en la quinta década de la vida y en zonas de bocio endémico, debido a escaso aporte nutricional de iodo. Se suele presentar como un nódulo único, indoloro sobre un tiroides con bocio o ya en forma de metástasis. Metastatiza vía sanguínea afectando a pulmón (más típico en gente de edad avanzada y sin síntomas) y hueso (más común en la infancia, produciendo dolor, inflamación y fracturas osteolíticas). Histológicamente es un tumor prácticamente idéntico al tejido tiroideo normal que deriva de células foliculares y su pronóstico de supervivencia se halla entre 63-75 % los 10 años.
El cáncer anaplásico es el menos común y representa en torno al 2% de los tumores tiroideos. También es más frecuente en mujeres, pero solo por encima de los 65 años. Se presenta como un nódulo único, doloroso, de consistencia pétrea, de rápido crecimiento y adherido al tejido circundante, con invasión precoz hacia laringe produciendo afonía y hacia esófago produciendo disfagia. Su diseminación es ganglionar, metastatizando de manera precoz a distancia por lo que el pronóstico es malo y su supervivencia es muy baja, apenas unos meses. Deriva también de células foliculares del tiroides, pero al ser muy agresivo las células están muy distorsionadas e infiltra con rapidez. Algunos tumores papilares pueden degenerar en anaplásicos.
El cáncer medular de tiroides es también infrecuente, constituyendo en torno al 2,5-10% de los tumores tiroideos y, a diferencia de los anteriores, la frecuencia entre hombres y mujeres es casi idéntica (1:1,3). Los casos esporádicos son diagnosticados durante la sexta o séptima década de la vida, pero los ligados a factores genéticos se diagnostica habitualmente en pacientes jóvenes (generalmente, antes de los 20 años). Se presenta como uno o varios nódulos no dolorosos o como metástasis a distancia en el momento del diagnóstico. Es muy típico el aumento de calcitonina en sangre ya que histológicamente deriva de las células parafoliculares del tiroides, productoras de calcitonina (de ahí el término de células C). En más del 10% se observan episodios intensos de diarrea sin que se conozca su etiología. Se disemina rápidamente por vías linfática y hematógena, y su pronóstico es mejor que el anaplásico, pero peor que papilar y folicular.
El componente genético es particularmente importante en el cáncer medular de tiroides, ya que una cuarta parte de los casos aparecen ligados a síndromes hereditarios (síndromes de neoplasia endocrina múltiple, MEN) con herencia autosómica dominante. Las principales vías oncogénicas de inicio y progreso de la carcinogénesis tiroidea son la MAPK (RAS/RAF/mitogen-activated protein kinase) y la PI3/Akt (phophatidylinositide 3-kinase), debido a la importancia que tienen en la supervivencia, proliferación, diferenciación y motilidad, y considerando que la malignificación celular implica la progresiva acumulación cinasas activadas o de genes supresores inactivados. Entre los condicionantes genéticos relacionados con el cáncer medular de tiroides, los más relevantes son los polimorfismos del protooncogén RET (Rearranged during transfection), presentes en el 95% de todos los casos familiares de cáncer medular de tiroides y en el 40-50% de los esporádicos. Hasta un 10% de los casos esporádicos también se relacionan con mutaciones RAF (KRAS/HRAS/NRAS) (Alonso-Gordoa, 2015).
El tratamiento del cáncer medular sin metástasis a distancia es la cirugía que, si se practica convenientemente a tiempo, permite con frecuencia considerar curado al paciente. La intervención suele consistir en la extirpación del tiroides junto con los ganglios cervicales, lo que implica un tratamiento con tiroxina de por vida. El principal biomarcador para el seguimiento de la evolución tumoral es el nivel de calcitonina en sangre: Si después de la cirugía persisten altas las concentraciones de calcitonina, esto sugiere que el tumor ha metastasizado. En caso de recidiva tumoral, siempre que no haya metástasis distales, puede reintentarse la extirpación del tumor o, en los casos donde no proceda la cirugía, radioterapia local o regional.
En los cuadros con metástasis distales, el enfoque suele ser conservador dado que se trata de un tumor que crece lentamente y que, con un tratamiento adecuado de los síntomas, puede mantenerse asintomático durante largo tiempo. La quimioterapia tiene una eficacia muy limitada en estos casos (con tasas de respuesta que no superan el 20%), aunque los protocolos con dacarbacina, doxorubicina y fluorouracilo pueden producir una estabilización prolongada del tumor.
La supervivencia a los cinco años para los pacientes con cáncer medular de tiroides de diseminación regional es cercana al 80%, tasa que desciende a la mitad en aquellos con metástasis distales, con una supervivencia media de 2-3 años. Los pacientes con la forma hereditaria de cáncer medular tienen un mejor pronóstico que aquellos con la forma esporádica, aunque posiblemente esto pueda deberse – al menos en parte – a un diagnóstico más precoz y, por tanto, a un tratamiento más eficaz.
ACCIÓN Y MECANISMO
El vandetanib es un inhibidor de diferentes tipos de tirosina cinasas, pero particularmente del receptor 2 del factor de crecimiento endotelial vascular (VEGFR-2), del receptor del factor de crecimiento epidérmico (EGFR, también denominado HER-1, erbB1 o c-erbB) y del protooncogén RET (Rearranged during transfection), así como – en menor medida – del receptor 3 del factor de crecimiento endotelial vascular (VEGFR-3). El medicamento ha sido autorizado para el tratamiento del cáncer medular de tiroides agresivo y sintomático en pacientes con enfermedad no resecable localmente avanzada o metastásica.
El vandetanib es un potente inhibidor de las tirosina cinasas mencionadas, compitiendo con el trifosfato de adenosina (ATP) en la zona catalítica de dichos enzimas, lo que da lugar a un bloqueo de la cascada de fosforilación y, por tanto, de la señalización bioquímica ligada al estímulo de los receptores mencionados por sus respectivos ligandos naturales.
La consecuencia farmacológica principal de la inhibición de las tirosina cinasas mencionadas es una inhibición de los procesos de angiogénesis tumoral; en concreto, la inhibición de las tirosina cinasas asociadas al VEGFR inhibe la formación de neovasos en los tumores. Por su parte, el efecto inhibidor del vandetanib sobre el EGFR impide la estimulación de las células tumorales y endoteliales. Las anomalías en el EGFR están involucradas en el complicado proceso de carcinogénesis de varios tipos de tumores sólidos, incluyendo la proliferación celular incontrolada, la migración celular, invasión del estroma, angiogénesis y resistencia a la apoptosis. Los ligandos específicos del EGFR son el propio EGF (Factor de Crecimiento Epidérmico) y otros péptidos relacionados con éste, entre los que cabe incluir el Factor de Crecimiento Transformante alfa (TGF-a) y la amfiregulina, entre otros. Tanto el EGF como el TGF-a son capaces de desencadenar, tras su acción sobre el EGFR, una serie de eventos citoquímicos necesarios para continuar con el ciclo de división celular.
Adicionalmente, los polimorfismos del protooncogén RET están presentes en el 95% de todos los casos familiares de cáncer medular de tiroides y en el 40-50% de los esporádicos, donde el vandetanib – activo tanto sobre las formas naturales o salvajes como sobre la mayoría de las formas mutadas de este gen – inhibe específicamente la proliferación de las líneas celulares del cáncer medular de tiroides.
ASPECTOS MOLECULARES
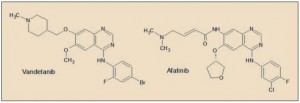
El vandetanib está estrechamente relacionado farmacológicamente con otros miembros de la serie de inhibidores de tirosina cinasas. Presenta una evidente relación estructural con el afatanib, un potente inhibidor de las tirosina cinasas asociadas al EGFR.
EFICACIA Y SEGURIDAD CLÍNICAS
La eficacia y la seguridad clínicas del vandetanib en la indicación autorizada han sido adecuadamente contrastadas mediante un ensayos clínico principal de fase III (Wells, 2012), multicéntrico, multinacional, aleatorizado, doblemente ciego y controlado con placebo, llevado a cabo sobre 331 pacientes con cáncer medular de tiroides no resecable localmente avanzado o metastásico, confirmado histológicamente y con una esperanza de vida de al menos 12 semanas, en el que los pacientes recibieron por vía oral un tratamiento a base de vandetanib (300 mg/24 h) o placebo hasta la confirmación de la progresión de la enfermedad. La mediana de edad de los pacientes era de 51 años, (18% <40 años), un 57% eran varones, 95% caucásicos, con una mediana de peso de 70 kg. Un 90% de los casos eran esporádicos y en un 95% había metástasis. Un 90% había sido sometido anteriormente a tiroidectomía, un 81% había recibido radioterapia y un 21% quimioterapia. La variable primaria de eficacia fue la supervivencia libre de progresión tumoral2, valorada de forma ciega y centralizada de acuerdo a criterios RECIST3. Como variables secundarias se determinaron la tasa global de respuesta y la supervivencia global, así como otros parámetros de tipo bioquímico.
Tras un seguimiento medio de 24 meses, el porcentaje de pacientes con progresión tumoral o muerte fue del 31,6% con vandetanib vs. 51,0% con placebo, lo que reduce el riesgo en un 54% (HR=0,46; IC95% 0,31 a 0,69; p>0,001). La mediana de tiempo fue de 19,3 meses con placebo pero no pudo calcularse directamente para el vandetanib, debido al insuficiente número de eventos requeridos estadísticamente; no obstante, utilizando una aproximación estadística (modelo de Weibull) la mediana fue de 30,5 meses con vandetanib y de 19,3 meses con placebo. El efecto sobre la supervivencia libre de progresión tumoral fue homogéneo en todos los subgrupos analizados en función del estatus tumoral.
La tasa de respuesta objetiva global fue del 45% vs. 13,0% (HR=5,48; IC95% 2,99 a 10,79; p>0,0001), aunque ninguno de los pacientes manifestó una respuesta completa (todas las respuestas fueron parciales). En cuanto a la supervivencia global, no pudo apreciarse una diferencia estadísticamente significativa debido a que en el momento de la valoración se habían producido menos del 50% (14% de fallacimientos con vandetanib y 16% con placebo) de los eventos requeridos para dicha evaluación (HR=0,89; IC95% 0,48 a 1,65). El tiempo hasta el empeoramiento del dolor4 fue de 7,9 vs. 3,3 meses. Asimismo, hubo una mejoría en el peso en el 28,6% vs. 11,0% (HR=3,24; IC95% 1,69 a 6,76; p=0,0003).
Considerando el estatus genético de los pacientes, la tasa de progresión tumoral a los 12 meses fue del 34,3% vs. 54,0% en pacientes RET+ y del 27,2% vs. 43,2% con estatus RET desconocido (el número de casos de RET- fue pequeño e insuficiente para validación estadística).
Desde el punto de vista de la seguridad clínica, la incidencia de eventos adversos relacionados con el tratamiento con vandetanib y placebo fue del 96,1% vs. 59,6% (55,4% vs. 24,2%, de grado ≥3). La tasa de mortalidad asociada a eventos adversos relacionados con el tratamiento fue del 2,2% vs. 2,0%. El porcentaje de pacientes que requirieron ajustes posológicos para controlar los efectos adversos fue del 35% vs. 3% y el de aquellos que suspendieron el tratamiento por este motivo fue del 12% vs. 3%.
Los eventos adversos más frecuentemente descritos con vandetanib y placebo en el ensayo clínico principal fueron diarrea (56,7% vs. 27,3%; 10,8% vs. 2,0% de grado ≥3 o 4), erupciones exantemáticas (88,7% vs. 23,2%; 6,9% vs. 0%), náusea (36,4% vs. 20,2%; 1,7% vs. 0%), hemorragias (15,6% vs. 11,1%; 1,7% vs. 0%), eventos relacionados con un alargamiento del intervalo QT del electrocardiograma (15,6% vs. 4,0%; 8,6% vs. 1,0%), hipertensión (32% vs. 5%) y cefalea (26% vs. 9%).
ASPECTOS INNOVADORES
El vandetanib es un inhibidor de tirosina cinasas, particularmente VEGFR-2, VEGFR-3, EGFR y RET; ha sido autorizado para el tratamiento del cáncer medular de tiroides agresivo y sintomático en pacientes con enfermedad irresecable localmente avanzada o metastásica. En este caso, se entiende como agresivos y sintomáticos aquellos casos en los que se constata un rápido deterioro del estado clínico (determinado por síntomas y por signos bioquímicos y radiológicos); es decir, aquellos que tienen necesidad urgente de tratamiento. En estos casos, parece que debe considerarse como la primera opción (Cooper, 2014).
La superioridad clínica del vandetanib sobre el placebo ha quedado constatada en estos pacientes, en los que incrementa de forma significativa la duración de la supervivencia libre de progresión tumoral (mediana de 30,5 vs. 19,3 meses), una superioridad que ha sido comprobada en función del estatus tumoral. Sin embargo, no se ha podido confirmar hasta ahora (debido a que no se ha registrado un número suficiente de eventos) un efecto sobre la supervivencia global, es decir, la mortalidad general de los pacientes.
Aunque su efecto parece ser clara en pacientes con un estatus genético de RET+ y en aquellos con estatus desconocido, no puede decirse lo mismo de aquellos RET-, cuyos datos son inconcluyentes. Por este motivo, la Agencia Europea de Medicamentos (EMA), dio un carácter condicional a su autorización de comercialización, condicionando la autorización definitiva a la realización de un ensayo clínico abierto en la Unión Europea5 en los que se comparen los resultados obtenidos en pacientes RET+ y RET- con cáncer medular de tipo esporádico (no familiar). En cualquier caso, la existencia de respuestas favorables en algunos casos de RET- como en pacientes con estatus RET desconocido, sugiere que el vandetanib podría ser útil en cuadros con otras mutaciones asociadas al cáncer medular de tiroides no relacionadas con RET (Alonso-Gordoa, 2015).
El medicamento presenta un perfil toxicológico importante, tanto por frecuencia como por relevancia clínica de los efectos adversos, destacando la diarrea y, en particular, el alargamiento del segmento QT del electrocardiograma, un signo de riesgo de graves arritmias cardiacas (especialmente, torsades de pointes). El vandetanib se asocia con un efecto dependiente de la dosis (que con la dosis recomendada de 300 mg/24 h es de 35 mseg de mediana), especialmente en las mujeres (75% vs. 25% en varones); en este sentido, la elevada semivida de eliminación del vandetanib (alrededor de 19 días) supone un problema, dado que la posología se ajusta fundamentalmente en función de la intensidad de los eventos adversos observados, particularmente con el alargamiento del segmento QT del electrocardiograma (y sus manifestaciones arrítmicas) y el potencial deterioro de la función renal, lo que podría conducir a la persistencia de altas concentraciones del fármaco durante periodos prolongados (incluso meses) después de haber finalizado el tratamiento o haber ajustado la posología. Por este motivo, la EMA ha requerido la remisión de datos adicionales para la selección de la dosis en la optimización del cociente beneficio/riesgo.
Por su parte, el Informe de Posicionamiento Terapéutico (AEMPS, 2013) recomienda el empleo de vandetanib en pacientes con cáncer medular de tiroides agresivo y sintomático con enfermedad metastásica, en los que exista evidencia radiológica de una franca progresión tumoral, así como una clara sintomatología clínica asociada a la enfermedad; también en aquellos en los que las lesiones no sean evaluables radiológicamente y que presenten un tiempo de duplicación de CTN o CEA menor de 24 meses; igualmente, en los pacientes con enfermedad locorregional no controlada y claramente sintomática, tras cirugía y/o tratamiento con radioterapia (incluso en ausencia de metástasis).
|
VALORACIÓN |
|
|---|---|
|
Vandetanib CAPRELSA® (AstraZeneca) |
|
|
Grupo Terapéutico (ATC): L01XE. TERAPIA ANTINEOPLÁSICA Y AGENTES INMUNOMODULADORES. Citostáticos: inhibidores directos de la proteína cinasa. |
|
|
Indicaciones autorizadas: Tratamiento del cáncer medular de tiroides agresivo y sintomático en pacientes con enfermedad no resecable localmente avanzada o metastásica. |
|
|
VALORACIÓN GLOBAL: INNOVACIÓN MODERADA. Aporta algunas mejoras, pero no implica cambios sustanciales en la terapéutica estándar. |
♣ ♣ |
|
Novedad clínica: Mejora la eficacia clínica del tratamiento farmacológico estándar. |
⇑ |
|
FÁRMACOS RELACIONADOS REGISTRADOS ANTERIORMENTE EN ESPAÑA |
|||
|---|---|---|---|
|
Fármaco |
Medicamento® |
Laboratorio |
Año |
|
Imatinib |
Glivec |
Novartis |
2002 |
|
Erlotinib |
Tarceva |
Roche |
2006 |
|
Sunitinib |
Sutent |
Pfizer |
2007 |
|
Dasatinib |
Sprycel |
Bristol Myers Squibb |
2007 |
|
Sorafenib |
Nexavar |
Bayer |
2007 |
|
Lapatinib |
Tyverb |
Glaxo |
2008 |
|
Nilotinib |
Tasigna |
Novartis |
2008 |
|
Gefitinib |
Iressa |
AstraZeneca |
2010 |
|
Pazopanib |
Votrient |
Glaxo |
2011 |
|
Crizotinib |
Xalkori |
Pfizer |
2014 |
|
Vemurafenib |
Zelboraf |
Roche |
2014 |
|
Dabrafenib |
Tafinlar |
GlaxoSmithKline |
2014 |
|
Axitinib |
Inlyta |
Pfizer |
2014 |
|
Afatinib |
Giotrif |
Boehringer Ingelheim |
2014 |
|
Ruxolitinib |
Jakavi |
Novartis |
2015 |
|
Vandetanib |
Caprelsa |
AstraZeneca |
2015 |
BIBLIOGRAFÍA
Bibliografía
- Agencia Española de Medicamentos y Productos Sanitarios (AEMPS). Informe de Posicionamiento Terapéutico de Vandetanib (Caprelsa®) en el cáncer medular de tiroides. PT/V1/15112013.1. Fecha de publicación: 22 de noviembre de 2013. http://www.aemps.gob.es/medicamentosUsoHumano/informesPublicos/docs/IPT-vandetanib-caprelsa.pdf
- Alonso-Gordoa T, Díez JJ, Durán M, Grande E. Advances in thyroid cancer treatment: latest evidence and clinical potential. Ther Adv Med Oncol. 2015; 7(1): 22-38. doi: 10.1177/1758834014551936.
- Bos Pueyo T, Baraibar Verdú E, Menéndez Alonso E, Salcedo Joven I, Panadero Carlavilla FJ. Cáncer de tiroides. Panorama Actual Med. 2012; 36(355): 558-66.
- Consejo General de Colegios Oficiales de Farmacéuticos. Bot PLUS WEB. https://botplusweb.portalfarma.com/
- Cooper MR, Yi SY, Alghamdi W, Shaheen DJ, Steinberg M. Vandetanib for the treatment of medullary thyroid carcinoma. Ann Pharmacother. 2014; 48(3): 387-94. doi: 10.1177/1060028013512791.
- European Medicines Agency (EMA). Caprelsa®. European Public Assessment Report (EPAR). EMA/92269/2012; EMEA/H/C/002315. http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_-_Public_assessment_report/human/002315/WC500123603.pdf
- Lope Carvajal V, Pollán Santamaría M. Epidemiología del cáncer de tiroides. Endocr Nutr. 2005; 52(supl1): 2-10.
- Wells SA Jr, Robinson BG, Gagel RF, Dralle H, Fagin JA, Santoro M, et al. Vandetanib in patients with locally advanced or metastatic medullary thyroid cancer: a randomized, double-blind phase III trial. J Clin Oncol. 2012; 30(2): 134-41. doi: 10.1200/JCO.2011.35.5040.
1 Hay también tumores (adenomas) epiteliales benignos de células foliculares.
2 Definida como la mediana del tiempo transcurrido entre el inicio del tratamiento y la objetivación de progresión tumoral o la muerte por cualquier causa del paciente, lo antes sucediese.
3 Response Evaluation Criteria in Solid Tumors.
4 Determinado mediante la puntuación del peor dolor soportado (Brief Pain Inventory, BPI) y el uso de analgésicos reportado por el propio paciente.
5 Con al menos el 60% de los pacientes procedentes de la Unión Europea.
Artículos relacionados
-
31 Oct 2024Medicamentos con nuevos principios activos o biosimilares Medicamentos con nuevos principios activos o biosimilares
-
7 Oct 2024Medicamentos con nuevos principios activos o biosimilares Medicamentos con nuevos principios activos o biosimilares
-
6 Ago 2024Medicamentos con nuevos principios activos o biosimilares Medicamentos con nuevos principios activos o biosimilares




