Vismodegib ▼Erivedge® (Roche) en carcinoma de células basales
 Nº394
Nº394
Resumen
El vismodegib es un inhibidor de la ruta “hedgehog”, implicada en la evolución del carcinoma de células basales. Ha sido autorizado condicionalmente para el tratamiento de pacientes adultos con carcinoma de células basales metastásico sintomático o localmente avanzado y no candidatos para cirugía o radioterapia. Las tasas de respuesta pueden considerarse moderadamente satisfactorias, aunque la mayoría es de carácter parcial, con una duración de la respuesta que oscila entre 7 y 10 meses. El vismodegib supone una nueva opción terapéutica para cuadros realmente infrecuente pero muy complicados, inabordables terapéuticamente mediante cirugía o radioterapia; asimismo, puede ser administrado por vía oral y proporciona una vía farmacológica innovadora, que además es potencialmente útil en otras formas diversas de cáncer. Todo ello, no obstante, sin olvidar su notable potencial toxicológico y teratogénico.
ASPECTOS FISIOPATOLÓGICOS
La piel es el órgano más grande y pesado del cuerpo humano. Cualquier estructura de la piel puede ser objeto de un proceso tumoral, aunque, en realidad, la mayoría de los tumores y, en particular, de los tumores neoplásicos (tumores cancerosos o precancerosos), tienden a localizarse en el estrato más externo: la epidermis. En concreto, los cánceres más frecuentes son el carcinoma basocelular (de células basales o basilioma), denominado así porque deriva de las células basales presentes en la capa más profunda de la epidermis (capa basal); el carcinoma epidermoide, cuyo nombre evoca obviamente a la epidermis; y el melanoma, que deriva de los melanocitos, las células productoras de melanina, el principal pigmento cutáneo (Cuéllar, 2014).
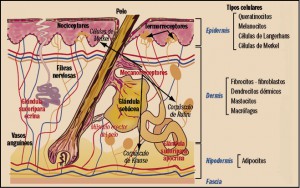
La piel constituye la cubierta externa de nuestro cuerpo. Se trata de un órgano trascendental, indispensable para la vida; de hecho, es el más grande de todos nuestros órganos, si exceptuamos los músculos considerados en conjunto. Su volumen representa el 12-15% del total, supone entre 7 y 12 kilogramos del peso total de un adulto y su superficie es de 1,5-2,5 m2; su grosor total oscila entre 0,5 mm (párpados) y 4 mm (piel del talón).
La piel se encuentra constituida por tres capas, muy diferentes en estructura y función, aunque íntimamente relacionadas entre sí. La más superficial o externa es la epidermis, la dermis es la capa intermedia y la hipodermis es la más profunda y de mayor peso. La piel se une por medio de fibras colágenas a la membrana superficial o fascia que recubre los músculos, proporcionado una gran solidez que opone una intensa resistencia a las fuerzas de desplazamiento tangencial.
La separación entre epidermis y dermis viene determinada por una línea ondulada donde se sitúan las papilas dérmicas y las crestas epidérmicas. Toda la estructura de la piel se sustenta sobre el tejido conectivo fibroso de las fascias y aponeurosis musculares, a las que se une para dar soporte y resistencia a la envoltura cutánea que cubre el cuerpo humano. La estructura de la epidermis es la de un epitelio de cubierta poliestratificado, es decir, formando varios estratos o capas superpuestas de células epidérmicas, denominadas queratinocitos. Desde la profundidad a la superficie, los estratos son:
- Basal (el más profundo, señalado con un 1 en la figura).
- Espinoso (2)
- Granuloso (3).
- Córneo (el superficial: 4). El estrato córneo de las palmas de las manos y de las plantas de los pies es muy grueso y contiene una subcapa llamada stratum lucidum (capa transparente).
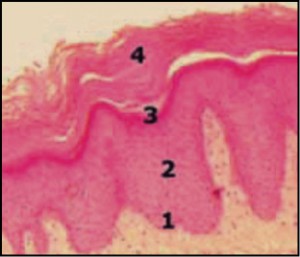
El grosor de la epidermis es variable y depende de la zona de piel: desde 30 μm (0,03 mm) para la epidermis de los párpados hasta 0,2 mm para la plantar. La capa basal forma una hilera de células (queratinocitos basales) colocadas en una línea ondulada, en contacto con la dermis y formando con ella una sólida unión dermo-epidérmica, en la que la dermis se introduce en la epidermis configurando ensenadas llamadas papilas dérmicas, y en donde la epidermis parece introducirse hacia la dermis formando cabos o salientes denominados crestas epidérmicas.
Los queratinocitos del estrato espinoso se unen por medio de unas estructuras que adosan las membranas celulares entre sí, los desmosomas. Por su parte, el estrato granuloso contiene queratinocitos que segregan al espacio extracelular una sustancia de naturaleza fosfolipídica asociada a mucopolisacáridos ácidos que evita la pérdida de agua. Sobre el estrato granuloso se disponen el estrato córneo, que es muy compacto en las regiones de piel que pertenecen a las palmas de las manos y a las plantas de los pies.
Toda la epidermis procede de la división celular de los queratinocitos basales, que al proliferar se sitúan unos encima de los otros y sufren un proceso progresivo de queratinización hasta llegar a la superficie, donde se descaman y se eliminan definitivamente como restos celulares muertos. Un ciclo celular de recambio epidérmico completo dura entre 50 y 75 días, desde que una célula del estrato basal se divide dando lugar a otra y ésta llega a la superficie, donde acaba formando escamas que, en el caso del cuero cabelludo, es la conocida y antiestética caspa.
En principio, cualquier estrato cutáneo puede ser objeto de tumoración y, de hecho, los procesos neoplásicos pueden afectar a cualquiera de las estirpes celulares que integran la piel; de acuerdo con ello, se pueden clasificar los tumores cutáneos más comunes según su origen celular (García Díez, 2011):
- Procedencia epitelial (fundamentalmente queratinocitos)
- Estados previos a la malignificación (precancerosis) y cánceres muy localizados (in situ): queratosis actínica, enfermedad de Bowen, etc.
- Cánceres invasivos: carcinoma epidermoide (de células escamosas) y carcinoma basocelular (de células basales)
- Otros tumores de origen epitelial: tumor de Merkel, enfermedad de Paget extramamaria, etc.
- Derivados de melanocitos: melanoma
- Otros tumores cutáneos (mayoritariamente localizados en la dermis)
- De estirpe fibrosa: dermatofibrosarcoma protuberans
- De estirpe vascular: angiosarcoma de Kaposi
Los cánceres procedentes de estirpes celulares queratinocíticas son, de lejos, los tipos de cáncer de piel más comunes. Entre ellos, los más frecuentes son los carcinomas de células basales y los de células escamosas (carcinoma epidermoide). El carcinoma basocelular (de células basales) es el tipo de cáncer de piel más común; de hecho, es el tipo de cáncer que se presenta con más frecuencia en los seres humanos, hasta el punto de que ocho de cada diez casos de cáncer de piel son carcinomas basocelulares. Por lo general, estos cánceres surgen en las zonas expuestas al sol, especialmente la cabeza y el cuello; y tienden a crecer lentamente. Afortunadamente, es muy infrecuente que se propague a otras partes del cuerpo (metástasis), aunque si no se trata, podría extenderse a los tejidos próximos e incluso llegar a afectar los huesos. Incluso después del tratamiento, el carcinoma basocelular puede reaparecer en el mismo lugar de la piel; de hecho, hasta la mitad de las personas diagnosticadas con cáncer de células basales padecerán un nuevo cáncer de piel dentro de los siguientes cinco años; por otro lado, las personas que han tenido cánceres de células basales también tienen una probabilidad mayor de padecer nuevos cánceres en otros lugares de la piel.
En general, se estima que el riesgo de padecer un carcinoma basocelular – la forma más común de cáncer cutáneo – a lo largo de la vida se estima entre un 28 y un 33%. Sea como fuere, a nivel mundial el cáncer de piel provocó 80.000 muertes en 2010; 49.000 de los cuales se deben a melanoma y 31.000 al resto de cánceres cutáneos (Lozano, 2012).
En Estados Unidos se calcula que el número de carcinomas basocelulares es de alrededor de 1,2 millones de casos al año, situándose en una tasa anual entre 407 y 485 casos por 100.000 habitantes en los hombres y 212-253 en las mujeres. En España, los datos de los que se dispone son limitados a algunas áreas geográficas. En Granada, el total de casos de cáncer de piel se encuentra en alrededor de 80 por 100.000 personas en varones y 60 por 100.000 en las mujeres. En Soria existe una proporción de 148 por 100.000 personas de carcinomas basocelulares y las cifras en Madrid rozan los 175 casos por 100.000 habitantes.
Se considera que la exposición a los rayos ultravioleta (UV) es el principal factor de riesgo de la mayoría de los cánceres de piel. La luz solar es la fuente principal de la radiación ultravioleta, aunque las lámparas utilizadas en los dispositivos (“camas”) bronceadores son otra fuente importante de rayos UV. El potencial efecto negativo de estos reside en su capacidad para dañar la estructura del ADN de las células cutáneas, especialmente aquella más superficiales como los queratinocitos y melanocitos (NCI, 2013).
El riesgo de cáncer de células basales aumenta a medida que las personas envejecen, aunque probablemente esto es una consecuencia directa de la acumulación de la exposición solar sobre la piel en el transcurso del tiempo. Aunque actualmente estos cánceres se están observando también en personas relativamente jóvenes, el motivo consiste en que éstas pasan más tiempo expuestas al sol. Por lo que respecta al sexo, en comparación con las mujeres, los hombres tienen el doble de probabilidades de padecer cáncer de células basales y alrededor del triple en el caso del cáncer de células escamosas. Como en el caso de la edad, posiblemente el motivo sea un mayor nivel de exposición al sol.
Las personas inmunodeprimidas (SIDA, tratamientos inmunosupresores, etc.) tienen más probabilidades de padecer cáncer de piel de tipo no melanoma. En particular, la tasa de cáncer cutáneo en las personas que han sido sometidos a trasplantes y tratados con terapia inmunosupresora puede llegar al 70% en los 20 años después del trasplante; asimismo, los cánceres cutáneos evolucionan más rápidamente y tienen mayor mortalidad entre las personas inmunodebilitadas.
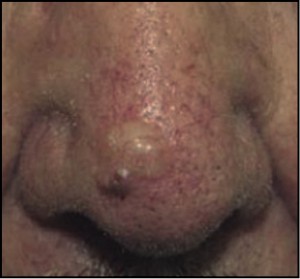
El carcinoma basocelular es también es denominado como epitelioma basocelular o basalioma. Aparece muy frecuentemente en la cara, pero puede aparecer en cualquier localización, siendo excepcional en palmas, plantas o mucosas, adoptando muy diversas formas de presentación. La lesión inicial suele ser una pequeña pápula indurada blancogrisácea recubierta por finas dilataciones de los capilares y vasos superficiales, conocidas como arañas vasculares o telangiectasias, que evoluciona a formas nodulares o a veces tomando el aspecto de una cicatriz.
Se puede manifestar como una úlcera que no cura y que muy lentamente va aumentando de tamaño; otras veces aparece como una lesión pigmentada que semeja un melanoma. El epitelioma basocelular superficial es una placa eritematosa que suele aparecer en tronco. Es un tumor de crecimiento lento y sólo de agresividad local pero, pero si se deja evolucionar es capaz de invadir estructuras subyacentes con importantes destrucciones de tejido, haciendo entonces muy difícil su tratamiento curativo. No obstante, la aparición de metástasis es excepcional.
Este tipo de cáncer guarda una estrecha relación con el tejido conectivo del entorno, observándose en el mismo una mayor expresión del receptor para el Factor de Crecimiento derivado de Plaquetas (PDGFR). Por otra parte, los fibroblastos podrían liberar citocinas que faciliten la supervivencia del epitelio tumoral. Quizás esta vinculación explica la dificultad de aparición de metástasis.
En el carcinoma basocelular se han encontrado mutaciones en los genes supresores de tumores p53 y PTCH, éste último asociado al síndrome del carcinoma basocelular nevoide (síndrome de Gorlin1) que se hereda de forma autosómica dominante y se expresa con la aparición precoz de estos tumores, alteraciones en los huesos (quistes mandibulares) y pequeñas depresiones en palmas y plantas.
El fenotipo hedgehog (hh) se descubrió en la mosca de la fruta (Drosophila malanogaster) como una mutación de polaridad de segmento, que proporciona información sobre la posición espacial durante el desarrollo embrionario de numerosos animales, incluyendo los seres humanos. En mamíferos existen tres genes homólogos de hh que intervienen en una gran variedad de procesos embrionarios: Sonic (Shh), Indian (Ihh) y Desert (Dhh). El más estudiado es Shh, que además de jugar un papel importante en el desarrollo del sistema nervioso central (las mutaciones que inactivan Shh en seres humanos producen holoprosencefalia), está implicado en la formación de los folículos pilosos, donde residen las células madre de la epidermis.
En la vía de señalización hedgehog intervienen cuatro proteínas importantes: Patched (ptch), Smoothenet (smo), Hedgehof (hh) y gli. El gen ptch codifica una proteína presente en la membrana celular (con 12 sectores de transmembrana), que se asocia con la proteína smo, también presente en la superficie celular (con 7 sectores de transmembrana) formando un complejo. Funciona como un receptor para el factor de crecimiento hh. En ausencia de hh, ptch y smo forman un complejo inactivo mediante el cual ptch inhibe a smo, que es la molécula que tiene actividad en la señalización intracelular. Cuando hh se une a ptch, smo se libera del freno impuesto por ptch y envía una señal al núcleo de la célula que conduce a la activación/represión de ciertos genes. Las mutaciones ptch activan constitutivamente la señalización de la vía hedgehog y conducen a alteraciones moleculares relacionadas con el cáncer. El factor de transcripción gli, activado por esta vía de señalización, promueve proliferación celular. En condiciones normales este factor se encuentra secuestrado en un complejo citoplasmático formado por proteínas asociadas al citoesqueleto como suf o fused. Cuando la vía se activa, gli se libera del complejo y en el núcleo regula la transcripción de sus genes diana (Wnt, BMPs, PDGFR, FOXE1, etc.). Gli está sobreexpresada en todos los tumores en los que está implicada la vía de señalización hedgehog y, de hecho, las mutaciones ptch son muy frecuentes (80-90%) en los carcinomas basocelulares esporádicos. También se han encontrado con cierta frecuencia mutaciones smo en estos tumores, actuando como un oncogén.
El objetivo general del tratamiento del cáncer cutáneo es la curación del proceso, lo que se consigue en la mayor parte de los carcinomas basocelulares. En general, el tratamiento es quirúrgico, aunque alternativamente se puede utilizar radioterapia. En principio, los tumores in situ pueden ser tratados con cirugía o con los diversos tratamientos médicos locales. La terapia sistémica, como norma general, se puede utilizar cuando no son tributarios de cirugía y son suficientemente invasivos o están diseminados.
La probabilidad de que el carcinoma cutáneo de células basales cáncer recurra varía desde menos de 5% para la cirugía Mohs hasta 15% o más para algunos otros, pero esto depende del tamaño del tumor. Los tumores pequeños tienen menos probabilidad de recurrir que los tumores más grandes. Incluso si el tumor regresa, a menudo se puede retratar eficazmente. El curetaje y la electrodesecación son tratamientos comunes para los carcinomas de células basales pequeños, aunque puede ser necesario repetirlos para asegurar el éxito completo. La cirugía de Mohs resulta especialmente útil en el tratamiento de tumores grandes, así como en aquellos en los que los bordes no están bien definidos, tumores localizados en o cerca de la nariz, los ojos, las orejas, la frente, el cuero cabelludo, los dedos y el área genital, así como aquellos que han reaparecido después de otros tratamientos. La criocirugía puede usarse en algunos carcinomas de células basales pequeños, pero usualmente no se recomienda para tumores más grandes, ni para tumores localizados en ciertas partes de la nariz, las orejas, los párpados, el cuero cabelludo o las piernas. A menudo, la radioterapia es una buena opción en el tratamiento de pacientes que no pueden tolerar la cirugía y para tumores que comprometen los párpados, la nariz o las áreas de las orejas que pueden ser difíciles de tratar quirúrgicamente. En una revisión sistemática de 27 ensayos controlados aleatorios que comparaban diferentes tratamientos (Bath-Hextall, 2007) se indicó que sólo el 50% de las recidivas se presentan dentro de los primeros 2 años, el 66% después de 3 años y 18% después de 5 años. En general, se considera que las tasas de recurrencia a 10 años son casi el doble de las tasas de recurrencia a 2 años.
Se estima (EMA, 2015) que la incidencia de los cuadros metastásicos es inferior al 0,1% de todos los casos carcinoma de células basales, en los que se han utilizado quimioterapia con complejos de platino y radioterapia, con una mediana de supervivencia de 8 a 10 meses. En cualquier caso, hasta la incorporación del vismodegib no se disponía de ningún medicamento oficialmente autorizado para el tratamiento de los cuadros localmente avanzados o metastásicos de carcinoma de células basales.
ACCIÓN Y MECANISMO
El vismodegib es un inhibidor de la ruta hedgehog, implicada en la evolución del carcinoma de células basales. Ha sido autorizado para el tratamiento de pacientes adultos con carcinoma de células basales metastásico sintomático o localmente avanzado y no candidatos para cirugía o radioterapia.
La ruta hedgehog guía la activación y la localización nuclear de los factores de transcripción de oncogén asociados a glioma (gli) y la inducción de los genes diana hedgehog (hh), a través de la proteína transmembrana smoothened (smo). Tales factores aparecen como involucrados en la proliferación, supervivencia y diferenciación celular de la gran mayoría (80-90%) de los cuadros de carcinoma de células basales cutáneas. El fármaco se une e inhibe la proteína smo, por lo que bloquea la señal de transducción hedgehog.
En condiciones normales, las señales de hh se inician por la interacción de ligandos hh con el receptor de ptch1. En el estado no unido, ptch1 previene la activación smo en el cilio primario, un orgánulo necesario para la transducción de diversas señales químicas y mecánicas. En presencia de ligando, ptch1 desaparece del cilio y smo activa efectores en la cadena de señalización, incluyendo la familia de factores de transcripción gli.
El vismodegib presenta un elevado potencial teratogénico es coherente con su mecanismo de acción, ya que el fenotipo hedgehog (hh) proporciona información de posición espacial durante el desarrollo embrionario de numerosos animales, incluyendo los seres humanos. Debido a ello, el medicamento podría provocar una notable toxicidad fetal a lo largo de todo el embarazo e incluso afectar al desarrollo posnatal. En este sentido, se han descrito defectos irreversibles sobre los dientes y cierre prematura la epífisis femoral en animales de experimentación (ratas), motivo por el cual el vismodegib está contraindicado en pacientes menores de 18 años.
ASPECTOS MOLECULARES
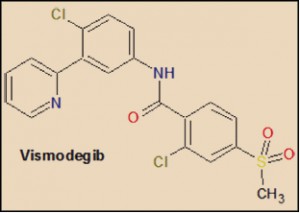
El vismodegib es una pequeña molécula sintética, cabeza de serie de un grupo de productos con potencial antineoplásico que deriva de las observaciones realizadas en la década de los 50 del pasado siglo realizadas con la ciclopamina, un alcaloide esteroídico presente en la planta Veratrum californicum, que está estructuralmente relacionado con la jervina (de hecho, se trata de la 11-desoxojervina).
El término ciclopamina deriva de la ciclopía2 provocada a las ovejas cuyas madres fueron alimentadas con forrajes que contenían V. californicum, observada en una granja de Idaho, y que fueron el origen de la investigación por parte del Departamento de Agricultura de los Estados Unidos. Tanto la ciclopamina como la jervina desarrollan potentes efectos teratógenos y antitumorales, como consecuencia de su capacidad para bloquear las respuestas celulares del sistema de señalización hedgehog, mediante su unión a proteína smo.
Es importante tener en cuenta que el vismodegib puede existir en su forma cristalina como varios polimorfos, de los que el B es la única forma que ha sido utilizada en el desarrollo clínico del medicamento. Asimismo, el tamaño de partícula de la forma sólida es considerado como crítico para el proceso de disolución y, por tanto, de absorción digestiva.
EFICACIA Y SEGURIDAD CLÍNICAS
La eficacia y la seguridad clínicas del vismodegib han sido adecuadamente contrastadas en las indicaciones autorizadas mediante un ensayo clínico principal (pivotal) de fase 2 (información preliminar sobre la eficacia), no aleatorizado, internacional, multicéntrico, con dos cohortes y un solo grupo de tratamiento (Sekulic, 2012).
Se incluyeron a 104 pacientes (aunque solo 96 fueron valorables para la eficacia clínica) adultos con una expectativa de vida de al menos 12 semanas. 71 de ellos (63 a efectos de evaluación) tenían un carcinoma localmente avanzado de células basales cutáneas, que presentaban una lesión histológicamente confirmada de al menos 10 mm en su diámetro mayor e inoperable quirúrgicamente (recurrencias múltiples, escasa probabilidad de éxito, riesgo elevado de deformidad, etc.). Asimismo, se incluyeron a 33 pacientes con metástasis confirmada histológicamente y mediante técnicas de imagen (pulmón, hígado, nódulos linfáticos o hueso). Todas las mujeres susceptibles de que quedar embarazadas incluidas en el estudio fueron asesoradas para la adopción de al menos dos métodos anticonceptivos eficaces desde el inicio del estudio hasta al menos tres meses después de finalizar el tratamiento. Todos los pacientes recibieron 150 mg/24 h de vismodegib por vía oral.
Las principales características demográficas y fisiopatológicas fueron: mediana de edad de 62 años (46% ≥65 años), 62% varones, 100% de raza blanca y mediana de peso de 79,5 kg. Un 32% de los pacientes presentaban tres o más lesiones cancerosas, siendo el 51% los pacientes con cáncer metastásico y el 17% aquellos con cáncer localmente avanzado, con unas medianas de tiempo desde el diagnóstico inicial de 66 y 169 meses, respectivamente. En los pacientes con cáncer metastásico, un 97% fueron sometidos previamente a cirugía, un 58% recibió radioterapia y un 30% tratamiento sistémico; en el caso de aquellos con cáncer localmente avanzado, fueron del 89%, 27% y 11%, respectivamente.
La variable primaria de eficacia utilizada fue la tasa de respuesta objetiva según un comité independiente. En la cohorte de pacientes con cáncer localmente avanzado, se consideró como respondedores a aquellos que cumplían de al menos uno de los siguientes criterios: reducción mayor del 30% en el tamaño total de las lesiones (suma del diámetro mayor de cada lesión) o resolución completa de la ulceración en todas las lesiones; por su parte, en los pacientes con cáncer metastásico, se consideró respondedores según los criterios RECIST 13. Como variables secundarias se determinaron, entre otras, la duración de la respuesta y la supervivencia sin progresión tumoral.
Los resultados mostraron una tasa de respondedores del 30% (todos parciales) en los pacientes con cáncer metastásico y del 43% (21% completas) en aquellos con cáncer localmente avanzado, según el comité independiente; según los investigadores, fueron del 44% (0% completas) y 60% (32% completas), respectivamente. La mediana de la duración de la respuesta objetiva según el comité independiente fue de 7,6 meses, tanto en los pacientes con cáncer localmente avanzado como metastásico; según los investigadores fueron de 7,6 y 12,9 meses, respectivamente. Por su parte, la mediana de la supervivencia en ausencia de progresión tumoral fue de 9,5 meses en ambos grupos de pacientes, según el comité independiente.
Doce meses después del primer análisis de resultados, la tasa de respuesta objetiva aumentó del 30 al 33% (ninguna completa) en los pacientes con cáncer metastásico y del 43 al 48% (22% completa) en aquellos con cáncer localmente avanzado; la mediana de la duración de la respuesta en estos últimos aumentó de 7,6 a 9,5 meses, manteniéndose en 7,6 para los pacientes metastásicos. Asimismo, la mediana de supervivencia en ausencia de progresión tumoral se mantuvo en 9,5 meses para ambas cohortes de pacientes (Sekulic, 2015).
En el análisis intermedio de otro estudio abierto y aleatorizado aún en desarrollo (STEVIE; Basset-Seguin, 2015), en el que 499 pacientes con carcinoma de células basales localmente avanzado (468) o metastásico (31) comenzaron un tratamiento oral con 150 mg/24 h de vismodegib. Aunque el objetivo primario de este estudio es determinar la seguridad del tratamiento (incidencia de eventos adversos hasta que la enfermedad progrese o aparezcan efectos tóxicos inaceptables), como objetivo secundario se determinaron algunas variables de eficacia. En concreto, la tasa de respondedores según criterio de los investigadores fue del 67% (34% respuestas completas) en los pacientes con cáncer localmente avanzado y del 38% (7% respuestas completas) con cáncer metastásico.
Desde el punto de vista de la seguridad, el vismodegib presenta un perfil toxicológico notable, con frecuentes e importantes efectos adversos; y ello sin olvidar su elevado potencial teratógeno. Los datos acumulados (EMA, 2015) indican que prácticamente el 100% de los pacientes tratados experimenta al menos un eventos adverso, siendo los más comunes los espasmos musculares (68%), alopecia (64%), disgeusia (51%), pérdida de peso (46%), fatiga (36%), náusea (28%) y diarrea o estreñimiento (20%). Por lo que se refiere a los eventos adversos más graves (grado >3), lo más comunes fueron pérdida de peso (7,2%), fatiga (5,8%) y espasmos musculares (3,6%); con una incidencia general mayor entre los pacientes con cáncer localmente avanzado que en aquellos con cáncer metastásico (47 vs. 33%), posiblemente relacionado con la mayor duración del tratamiento con vismodegib. Un 12% (3% con cáncer localmente avanzado y 16% con cáncer metastásico) de los pacientes que abandonaron el tratamiento fue por la aparición de eventos adversos. El número total de muertos asociados a eventos adversos fue de 3 (sobre un total de 104; 2,9%).
Por su parte, en el estudio STEVIE, la tasa de eventos adversos fue del 98%, fundamentalmente espasmos musculares (64%), alopecie (62%), disgeusia (54%), pérdida de peso (33%), astenia (28%), reducción del apetito (25%), diarrea (17%), náusea (16%) y fatiga (16%). La tasa de eventos adversos graves fue del 22%. De los 31 pacientes que murieron durante el seguimiento (de un total de 499), en 21 (4,2%) de ellos fue como resultado de un evento adverso.
ASPECTOS INNOVADORES
El vismodegib es un inhibidor de la ruta hedgehog, implicada en la evolución del carcinoma de células basales. Ha sido autorizado condicionalmente4 para el tratamiento de pacientes adultos con carcinoma de células basales metastásico sintomático o localmente avanzado y no candidatos para cirugía o radioterapia.
La ruta hedgehog guía la activación y la localización nuclear de los factores de transcripción de oncogén asociados a glioma (gli) y la inducción de los genes diana hedgehog (Hh), a través de la proteína transmembrana smoothened (smo). Tales factores aparecen como involucrados en la proliferación, supervivencia y diferenciación celular de la gran mayoría (80-90%) de los cuadros de carcinoma de células basales cutáneas. El fármaco se une e inhibe la proteína smo, por lo que bloquea la señal de transducción hedgehog.
Los datos clínicos disponibles son muy limitados y metodológicamente no muy robustos. Los ofrecidos por el estudio pivotal (un estudio de fase 2) indican una tasa de respondedores del 48% (22% con respuesta completa) entre los pacientes con cáncer de células basales localmente avanzado, con una duración mediana de su respuesta de 9,5 meses. En el caso de los pacientes con cáncer metastásico, la tasa de respondedores fue del 33%, ninguno de ellos con respuesta completa, y una duración mediana de la respuesta de 7,6 meses. Los datos correspondientes al análisis intermedio de uno de los estudios que están actualmente en curso (STEVIE) están en línea con el mencionado nivel de respuesta.
Desde el punto de vista de la seguridad, el vismodegib produce frecuentes e importantes efectos adversos, a lo que hay que añadir un elevado potencial teratógeno. Prácticamente todos los pacientes experimentan algún eventos adverso, siendo los más comunes espasmos musculares, alopecia, disgeusia, pérdida de peso, fatiga, náusea y diarrea o estreñimiento. Un 12% (3% con cáncer localmente avanzado y 16% con cáncer metastásico) de los pacientes que abandonaron el tratamiento fue por la aparición de eventos adversos y la mortalidad asociada a eventos adversos es del 3%.
Las tasas de respuesta pueden considerarse moderadamente satisfactorias, aunque la mayoría es de carácter parcial, con una duración de la respuesta que oscila entre 7 y 10 meses. Por otro lado, los datos relativos a la enfermedad metastásica están soportados solo por un pequeño grupo de pacientes (33 en el estudio pivotal y 31 en el STEVIE), algo que, aunque es razonable dado la excepcionalmente baja incidencia de casos metastásicos en el carcinoma de células basales cutáneas, limita la consistencia de los resultados. Este es uno de los motivos por los que la EMA ha decidido dar al medicamento una autorización condicional, no definitiva.
Por otro lado, deben destacarse las notables diferencias encontradas entre las variables, según fuesen valoradas por un comité independiente o por los investigadores. Así, la tasa de respondedores en los pacientes con cáncer metastásico fue del 30% (0% respuestas completas) para el comité independiente vs. 44% (0% completas), según los investigadores; asimismo, fueron del 43% (21% completas) vs. 60% (32% completas) en cáncer localmente avanzado. Estas diferencias no ayudan precisamente a establecer el verdadero papel del vismodegib en las formas no tratables quirúrgica o radiológicamente del carcinoma de células basales.
Asimismo, unas tasas de respuestas que oscilan entre el 33% y el 48%, mayoritariamente parciales y de duración limitada (7-10 meses), supone que sigue habiendo una mayoría de pacientes (52-67%) que no responden satisfactoriamente al vismodegib. Y debe tenerse en cuenta que aunque la definición de cáncer metastásico es clara, la de cáncer localmente avanzado no lo es en la misma medida. Algunos dermatólogos han sugerido que el uso del medicamento podría ser “desviado” a cualquier paciente con carcinoma de células basales que no acepte un tratamiento quirúrgico o de radioterapia, o con tumores múltiples, aunque no sea avanzado.
Con todo y con ello, no cabe duda de que el vismodegib supone una nueva opción terapéutica para cuadros realmente infrecuentes pero muy complicados, inabordables terapéuticamente mediante cirugía o radioterapia; asimismo, puede ser administrado por vía oral (aunque con limitaciones en su biodisponibilidad) y proporciona una vía farmacológica innovadora, que además es potencialmente útil en otras formas diversas de cáncer. Todo ello, no obstante, sin olvidar su notable potencial toxicológico y teratogénico.
|
VALORACIÓN |
|
VISMODEGIB
|
|
Grupo Terapéutico (ATC): L01XX. AGENTES ANTINEOPLÁSICOS E INMUNOMODULADORES. Otros agentes antineoplásicos. |
|
Indicaciones autorizadas: Tratamiento de pacientes adultos con carcinoma de células basales metastásico sintomático o localmente avanzado y no candidatos para cirugía o radioterapia. |
|
INNOVACIÓN importante. Aportación sustancial a la terapéutica estándar |
|
Novedad clínica: Mejora la eficacia clínica con relación al tratamiento estándar y supone la incorporación de una nueva vía terapéutica. |
|
Novedad molecular: Incorpora un mecanismo de acción innovador frente al de los tratamientos previamente disponibles para la misma o similar indicación terapéutica. |
BIBLIOGRAFÍA
Bibliografía
- Basset-Seguin N, Hauschild A, Grob JJ, Kunstfeld R, Dréno B, Mortier L, et al Vismodegib in patients with advanced basal cell carcinoma (STEVIE): a pre-planned interim analysis of an international, open-label trial. Lancet Oncol. 2015; 16(6): 729-36. doi: 10.1016/S1470-2045(15)70198-1.
- Bath-Hextall FJ, Perkins W, Bong J, et al. Interventions for basal cell carcinoma of the skin. Cochrane Database Syst Rev (1): CD003412, 2007.
- Consejo General de Colegios Oficiales de Farmacéuticos. Bot PLUS WEB. https://botplusweb.portalfarma.com/
- Cuéllar Rodríguez S. Cáncer de piel (basilioma, melanoma, carcinoma epidermoide). Panorama Actual Med. 2014; 38(375): 567-84.
- European Medicines Agency (EMA). Erivedge®. European Public Assessment Report (EPAR). EMA/43679/2015; EMEA/H/C/002602. http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_-_Public_assessment_report/human/002602/WC500146820.pdf
- García Díez A. Terapéutica farmacológica de los cánceres cutáneos. En: Terapéutica farmacológica de los trastornos neoplásicos e inmunológicos. Consejo General de Colegios Oficiales de Farmacéuticos. Madrid; 2011. p. 307-20.
- Lozano R. Global and regional mortality from 235 causes of death for 20 age groups in 1990 and 2010: a systematic analysis for the Global Burden of Disease Study 2010. Lancet 2012; 380 (9859): 2095–128. doi:10.1016/S0140-6736(12)61728-0.
- NCI (National Cancer Institute). Skin Cancer Treatment. http://www.cancer.gov/cancertopics/pdq/treatment/skin/HealthProfessional (2013).
- Sekulic A, Migden MR, Lewis K, Hainsworth JD, Solomon JA, Yoo S, et al; ERIVANCE BCC investigators. Pivotal ERIVANCE basal cell carcinoma (BCC) study: 12-month update of efficacy and safety of vismodegib in advanced BCC. J Am Acad Dermatol. 2015; 72(6): 1021-6.e8. doi: 10.1016/j.jaad.2015.03.021.
- Sekulic A, Migden MR, Oro AE, Dirix L, Lewis KD, Hainsworth JD, et al. Efficacy and safety of vismodegib in advanced basal-cell carcinoma. N Engl J Med. 2012; 366(23): 2171-9. doi: 10.1056/NEJMoa1113713.
1 Un síndrome hereditario asociado a la translocación cromosómica 9q22.3-9q31. La inactivación de un alelo de este gen es suficiente para que se desarrollen diversos tipos de tumores: carcinomas basocelulares, fibromas, fibrosarcomas, meduloblastomas, rabdomiosarcomas y meningiomas.
2 Implica la existencia de una única órbita facial, lo que proporciona a la cara el aspecto de los míticos cíclopes, con su característico ojo único en el centro de la frente. La ciclopía se asocia a holoprosencefalia alobar.
3 Criterios RECIST (Response Evaluation Criteria in Solid Tumors). Definen lo que son las lesiones medibles (a partir de 10 mm) y no medibles, las lesiones diana (las más representativas de la afectación tumoral) y no diana, y utiliza una medida unidimensional de las lesiones (su diámetro mayor).
4 La autorización condicional implica una decisión favorable de la Agencia Europea de Medicamentos (EMA) a partir de los datos aportados por el laboratorio titular del medicamento que, aunque no son todo lo completos que deberían ser, indican que los beneficios del medicamento son mayores que sus riesgos; con ello, el laboratorio titular adquiere la obligación de aportar estudios adicionales que complementen o amplíen los previamente suministrados. La aprobación se renueva una vez al año hasta que se hayan cumplido todas las obligaciones y, en su caso, la autorización condicional se convierte en una normal. Las autorizaciones condicionales solo se conceden a aquellos medicamentos que satisfacen una “necesidad médica no satisfecha”, lo que significa que el medicamento está destinado para una enfermedad o afección para la que no se dispone actualmente de ningún tratamiento eficaz y es, por lo tanto, importante que los pacientes puedan tener un acceso lo más temprano posible.
Artículos relacionados
-
5 Dic 2025Medicamentos con nuevos principios activos o biosimilares Medicamentos con nuevos principios activos o biosimilares
-
29 Oct 2025Medicamentos con nuevos principios activos o biosimilares Medicamentos con nuevos principios activos o biosimilares
-
6 Oct 2025Medicamentos con nuevos principios activos o biosimilares Medicamentos con nuevos principios activos o biosimilares





