Patologías del aparato reproductor femenino y contracepción
 Nº434
Nº434
Alteraciones de la fertilidad
Infertilidad femenina
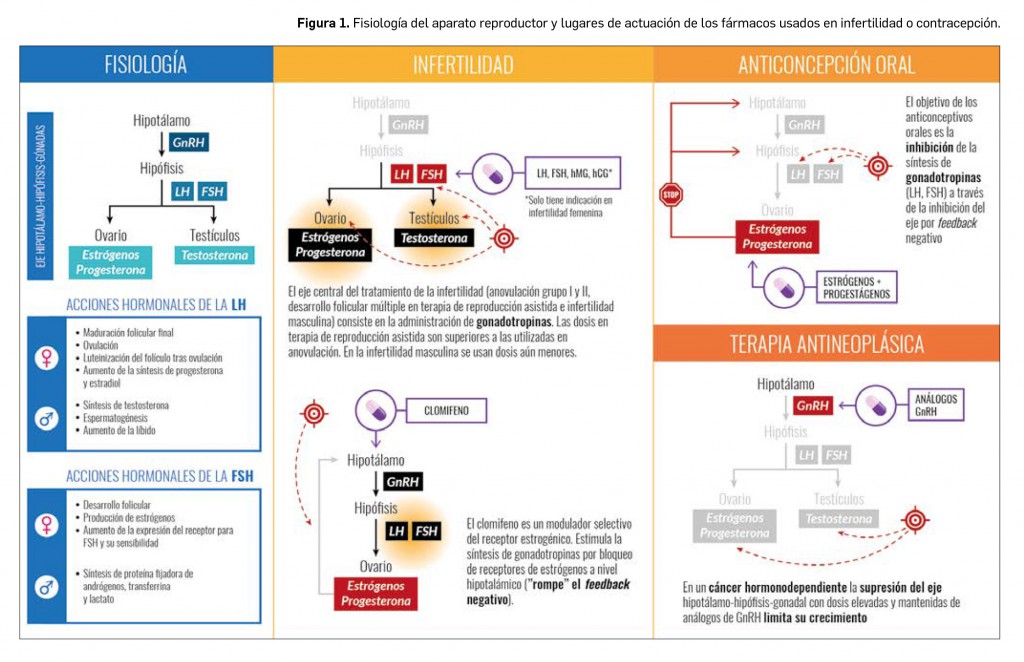
Las alteraciones del funcionalismo ovárico pueden clasificarse de manera general en: a) primarias, cuando el trastorno es de origen ovárico; b) secundarias, cuando es hipofisario (fallo en las gonadotropinas); y c) terciarias, cuando el problema está localizado en el hipotálamo. Lo más frecuente es que la infertilidad se deba a una hipofunción o disfunción de estos órganos, siendo mucho más raro que la causa sea una hiperfunción. En todas estas situaciones la mujer tiene dificultades importantes para quedarse embarazada. En cualquier caso, se requiere de la administración de gonadotropinas y/o de hormonas hipotalámicas para recuperar la fertilidad.
Durante los últimos años han adquirido gran desarrollo las técnicas que conocemos como técnicas de reproducción asistida (TRA), que combinan la estimulación ovulatoria, para conseguir un desarrollo folicular múltiple, con la preparación y capacitación del semen en el laboratorio para depositarlo posteriormente en el interior de la cavidad uterina –ya sea por inseminación artificial intraconyugal (IAC) como por inseminación artificial de donante (IAD)–, o bien proceder a su cultivo con ovocitos en el laboratorio para fecundarlos y obtener embriones que serán finalmente transferidos a la cavidad uterina, técnica conocida comúnmente como fecundación in vitro (FIV).
Los mayores riesgos están relacionados con la hiperestimulación ovárica (embarazo múltiple) y el desarrollo de malformaciones fetales. La política actual es limitar el número de embriones a transferir en función de la edad de la paciente y de la tasa de fecundación. Actualmente hay una baja incidencia de embarazos múltiples y la tasa de malformaciones no supera la de un embarazo normal.
Tratamiento
El tratamiento tiene como objetivo incrementar la liberación de gonadotropinas para conseguir la ovulación. Esto puede conseguirse bien rompiendo el feedback negativo que regula a la baja esta liberación (clomifeno) o supliendo ese déficit de gonadotropinas con aporte exógeno.
- Clomifeno: bloquea receptores estrogénicos en el hipotálamo, de manera que se estimula el eje hipotálamo-hipófisis-ovario al romperse el feedback negativo, incrementando así la síntesis endógena de gonadotropinas. Se administran 50 mg desde el día 5 del ciclo durante 5 días consecutivos (días 5 a 9) con el objetivo de estimular la FSH y conseguir así un adecuado desarrollo folicular. Si no se consiguiese la ovulación puede repetirse la administración al mes siguiente con una dosis de 100 mg. El número máximo de intentos (6) está limitado por el riesgo de cáncer de ovario.
- Gonadotropinas: suplen el déficit de hormonas endógenas y favorecen todos los procesos necesarios (desarrollo folicular, ovulación, mantenimiento del cuerpo lúteo) para que ocurra el embarazo. Las gonadotropinas no se absorben por vía oral, por lo que su administración se realiza vía subcutánea o intramuscular.
- Anovulación grupo I o hipogonadismo hipogonadotropo: en esta situación existe un déficit de hormonas sexuales (estrógenos y progesterona) que requiere de la administración tanto de FSH como de LH para su tratamiento. Pueden utilizarse ambas hormonas o hMG (gonadotropina menopáusica) que tiene acción tanto FSH como LH.
- Anovulación grupo II o disfunción hipotalámica con niveles altos de estrógenos: los estrógenos inhiben en mayor grado la liberación de FSH a nivel hipofisario, por lo que en muchos casos de este tipo de infertilidad será suficiente con el aporte de FSH exógena. En la terapia de reproducción asistida (TRA) es necesario utilizar dosis mayores de hormonas que permitan una ovulación múltiple.
- Análogos de GnRH: pueden utilizarse como alternativa terapéutica a las gonadotropinas con la misma finalidad. Una característica crucial es que la administración debe realizarse vía subcutánea en pulsos, o de lo contrario una administración continua produce el efecto opuesto: inhibición del eje hipotálamo-hipófisis-gónadas. Una utilidad exclusiva de este grupo de fármacos es determinar en el diagnóstico diferencial del hipogonadismo hipogonadotropo si es de origen hipotalámico o hipofisario. En caso de que sea hipotalámico la administración intravenosa de GnRH o sus análogos restablece el eje, mientras que si el origen es hipofisario, no se observa respuesta en la liberación de gonadotropinas.
- Antagonistas de GnRH: son fármacos con un papel más relevante en la terapia antineoplásica que en la infertilidad. En esta última tienen utilidad para inhibir el pico de gonadotropinas espontáneo que pueden aparecer tras los tratamientos estimulantes ovulatorios.
Infertilidad masculina
El tratamiento de la infertilidad masculina se basa también en la administración de gonadotropinas. Estas hormonas en el varón son responsables de la síntesis de testosterona en los testículos y la espermatogénesis. Las mismas gonadotropinas que se utilizan en la infertilidad femenina pueden ser utilizadas en la masculina, si bien es verdad que no en ficha técnica de todas ellas se recogen estas indicaciones.
Contracepción
Métodos de abstinencia
Consisten en evitar las relaciones sexuales en los momentos en los que existe mayor riesgo de embarazo (los días próximos a la ovulación). Coincidiendo con la ovulación ocurren una serie de cambios fisiológicos como la elevación de la temperatura corporal 0,5ºC o cambios en el flujo vaginal que se vuelve más filante, cuya observación puede utilizarse para incrementar la eficacia del método. De estas variables derivan tres métodos anticonceptivos:
- Método Ogino: la abstinencia únicamente está basada en planificación sobre el calendario; se consideran seguras la primera y última semana del ciclo menstrual.
- Método de Billings: consiste en la observación de cambios en el mucus.
- Método sintotérmico: combina el método de Billings con la observación de cambios en la temperatura corporal (se produce un aumento brusco de 0,5ºC en el momento de la ovulación).
Estos métodos son con claridad los menos eficaces, ya que para que la planificación pueda ser efectiva se requiere un ciclo muy regular. Además, los cambios fisiológicos que se utilizan como indicadores de ovulación son difíciles de interpretar y muchas veces pueden verse afectados por otros motivos.
Métodos de barrera
Interfieren con el ascenso de los espermatozoides por el tracto genital femenino. Son métodos muy utilizados debido a su inocuidad y bajo coste. Entre estos métodos se encuentran los espermicidas, diafragma, preservativos (masculino y femenino) –que además son útiles para la prevención del contagio de enfermedades de transmisión sexual (ETS)–, capuchón cervical y esponja anticonceptiva.
Métodos anovulatorios
Son los anticonceptivos hormonales, fármacos que suprimen el pico de LH e impiden que durante el ciclo tenga lugar la ovulación e inhiben la FSH impidiendo el desarrollo folicular.
- Anticonceptivos orales: los más utilizados son los combinados (estrógeno más progestágeno) por encima de los progestágenos como monofármacos.
- Anticonceptivos inyectables: son de administración subcutánea o intramuscular; tienen una duración de varios meses.
- Implantes subdérmicos: solo están compuestos por progestágenos; tienen una duración muy prolongada (varios años). Eliminan los posibles problemas de adherencia al tratamiento.
- Parche transdérmico: es una alternativa similar a los anticonceptivos orales que permite la cesión controlada de hormonas.
- Anillo vaginal: es una alternativa –muy demandada– a los anticonceptivos orales que mejora la adherencia y permite reducir las concentraciones plasmáticas máximas de hormonas gracias a su liberación sostenida.
Métodos que evitan la implantación de oocito
En este grupo se encuadran los anticonceptivos de emergencia y los dispositivos intrauterinos (DIU):
- Anticoncepción de emergencia: se fundamenta en el uso de dosis altas de progestágenos (ulipristal, levonorgestrel) en una única toma. Se considera que estos fármacos producen unos cambios sobre el mucus y endometrio que imposibilitan la implantación del oocito, si bien administrados de forma previa al pico de LH, podrían inhibirlo, dando lugar a un ciclo anovulatorio. La contribución de cada una de estas acciones al efecto anticonceptivo total es muy controvertida.
- DIU: es un dispositivo en forma de “T” que se coloca en el útero mediante intervención. Contienen metales (cobre, y algunos de ellos, también plata u oro) o progestágenos que inducen una serie de modificaciones locales celulares y bioquímicas en el endometrio, que interfieren con el transporte y capacitación espermática y con la implantación del oocito. Tienen una duración de 2-5 años.
Síndrome del ovario poliquístico
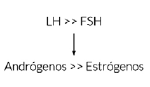
El síndrome del ovario poliquístico (SOPQ) es la causa más común de anovulación e hirsutismo en la mujer. Se debe a alteraciones heterogéneas entre las que se encuentran: el incremento de las concentraciones séricas de LH con respecto a las de FSH, el aumento de las concentraciones intraováricas de andrógenos con respecto a las de estrógenos, o una mayor frecuencia de atresias foliculares. Al menos una de las anteriores variables debe estar presente para que se desarrolle esta patología.
La anovulación, que ocurre como consecuencia de las concentraciones elevadas de LH, origina un aumento de niveles de andrógenos, diminución de los niveles de progesterona y aumento de los andrógenos reducidos en posición 5α. Estos últimos son responsables de la aparición de hirsutismo.
La resistencia a la insulina es un hallazgo común en el SOPQ. La obesidad se ha considerado como una de las causas de resistencia a la insulina en pacientes con SOPQ, así como el hiperandrogenismo. Todo esto se ha reinterpretado últimamente bajo nuevas perspectivas haciendo cada vez más hincapié en los efectos negativos a muchos niveles de la resistencia a la insulina. Las niñas prepúberes con obesidad mórbida a menudo muestran hiperinsulinemia e hiperandrogenismo que se asocian al desarrollo futuro de SOPQ.
Los resultados de un reciente estudio muestran que el tratamiento con metformina junto con modificaciones del estilo de vida dieron lugar a una disminución del índice de masa corporal (IMC) y de los niveles de andrógenos, retrasó la menarquia y redujo la frecuencia de oligomenorrea, observándose en el grupo tratado una incidencia notablemente menor (5% vs 45%) de manifestaciones precoces de SOPQ observadas mediante ecografía.
Tratamiento
Quirúrgico
La eliminación de tejido ovárico (resección ovárica en cuña) origina una disminución de las concentraciones intraovárica y periférica de testosterona, y de las concentraciones séricas de estrógenos.
Farmacológico
- Análogos de GnRH: su administración continuada inhibe el eje hipotálamo-hipófisis-ovario reduciendo con ello la producción ovárica de andrógenos.
- Anticonceptivos orales y progestágenos: interrumpen la secreción anormal de gonadotropinas, con la consiguiente disminución en la producción de andrógenos. Los estrógenos y progestágenos combinados normalizan los niveles de LH e incrementan las globulinas transportadoras de hormonas sexuales (SHBG) en estas pacientes, aumentando su capacidad de unión a la testosterona.
- Glucocorticoides: están especialmente indicados para revertir la hiperandrogenemia de origen adrenal presente en algunas pacientes con dicha patología.
- Otros fármacos: pueden emplearse antiandrógenos y también gonadotropinas (básicamente FSH) cuando se busca fertilidad en estas mujeres. También se utiliza el citrato de clomifeno como estimulante de la ovulación, acompañado de metformina para reducir la resistencia a la insulina.
Hirsutismo
Se define como un exceso de pelo terminal, grueso y pigmentado, distribuido según el patrón masculino adulto. Esta distribución lo distingue de la hipertricosis, caracterizada por el aumento de vello fino distribuido de modo difuso por toda la superficie corporal. El hirsutismo se considera un signo cutáneo de alteraciones androgénicas que pueden responder a dos tipos de mecanismos patogénicos: un exceso de andrógenos libres (hiperandrogenismo) y una mayor sensibilidad de los folículos pilosos a los andrógenos (hirsutismo periférico).
El tratamiento se basa en la acción antiandrogénica, que se puede conseguir a través de varios mecanismos:
- Anticonceptivos orales: actúan principalmente inhibiendo la producción hipofisaria de gonadotropinas y aumentando, por acción de los estrógenos, la síntesis hepática de SHBG, con lo que disminuye la testosterona libre circulante. Existen medicamentos con la asociación de etinilestradiol (2 mg) y acetato de ciproterona (35 µg), específicamente indicados en esta patología (Diane®, Gyneplen® y EFG).
- Análogos de GnRH: su administración continuada inhibe la producción de gonadotropinas y, secundariamente, frenan la función gonadal. Están indicados en hiperandrogenismo de origen ovárico y se obtienen respuestas en el 80% de los casos de hirsutismo. Provocan amenorrea y déficit estrogénico (sofocos, cambios en la libido, etc.), por lo que deben asociarse a preparados estrogénicos.
- Glucocorticoides: son el tratamiento de elección en los defectos enzimáticos de las glándulas suprarrenales o si se desea mantener la fertilidad (los anticonceptivos y análogos de GnRH hacen inviable el embarazo), aunque son poco eficaces si no se asocian a antiandrógenos.
- Antiandrógenos: constituyen el tratamiento de elección. Bloquean la unión de la testosterona y de la dihidrotestosterona (DHT) al receptor androgénico. Reducen el crecimiento del vello en un 70% de los casos. Antes del inicio del tratamiento debe descartarse que exista embarazo. Dentro de este grupo se encuentran la espironolactona, el acetato de ciproterona y los inhibidores de la 5-α-reductasa (finasterida).
- Eflornitina (Vaniqa®): es un inhibidor irreversible de la ornitina descarboxilasa, enzima implicada en la producción del folículo piloso, y se encuentra autorizada específicamente, por vía tópica, en el tratamiento del hirsutismo facial en mujeres.
Endometriosis
Es una enfermedad benigna que se caracteriza por la presencia de implantes ectópicos de tejido endometrial a nivel de la superficie externa del útero, ovarios, trompas, peritoneo, intestino, etc. Llega a afectar al 15% de las mujeres en edad reproductiva. Tales implantes de endometrio ectópico mantienen una cierta actividad funcional, lo que acaba generando adherencias y fibrosis a nivel de cada unidad tubo-ovárica. Esto determina problemas para la captación ovular y el transporte de gametos. La alta concentración de macrófagos peritoneales, habitual en estas pacientes, interfiere tanto en el transporte como en la supervivencia espermática. Los síntomas más importantes son: dolor abdominal errático, sangrado intermenstrual, dispareunia y esterilidad.
La base del tratamiento consiste en suprimir la llegada de las gonadotropinas a los ovarios, luos cuales, al disminuir el aporte estrogénico a los implantes endometriósicos ectópicos, se atrofiarán temporalmente:
- Danazol: inhibe la producción hipofisaria de gonadotropinas y, por tanto, disminuye de forma indirecta la producción de estrógenos ováricos; por otro lado, inhibe de forma directa la síntesis ovárica de esteroides. Además, ejerce acción antiprogestagénica, antiestrogénica y antiandrogénica, al unirse a los receptores de estas hormonas.
- Análogos de GnRH (nafarelina): induce una desensibilización hipofisaria crónica que provoca un estado menopáusico que se mantiene varios meses (y que se acompañará de sus correspondientes síntomas).
- Antagonistas de GnRH: tienen la misma finalidad que los agonistas de GnRH pero deben sus efectos a su carácter antagonista y no a la desensibilización de receptores. Elagolix es un fármaco autorizado con esta indicación pero no está comercializado en España.
En algunos casos será necesario el tratamiento quirúrgico mediante cirugía endoscópica para la extirpación de los endometriomas. Tanto si se ha empleado un tratamiento médico, como si ha sido quirúrgico o combinado, la mitad de las pacientes seguirán siendo estériles y necesitarán recurrir a TRA.
Patología mamaria
Ginecomastia
Se define como un aumento de tamaño de la glándula mamaria a expensas del tejido glandular, en un varón y de naturaleza benigna. Puede aparecer como una manifestación fisiológica durante la pubertad, pero también en el curso de alteraciones endocrinas, u originarse por la acción de algunos fármacos (espironolactona, ketoconazol) o sustancias (esteroides anabolizantes). Es habitual que aparezca en la pubertad con remisión en 12-18 meses cuando se estabilizan los niveles de testosterona o en ancianos como consecuencia de la pérdida de esta hormona. El tratamiento farmacológico no ha demostrado ser especialmente eficaz. La resección quirúrgica está indicada si existen problemas psicológicos graves, si persiste más de 2 años y si alcanza un tamaño importante.
Galactorrea
Se define como la secreción láctea de la glándula mamaria femenina fuera del periodo puerperal y que, además, persiste más de 6 meses. La causa más frecuente es la alteración de la prolactina, aunque su aumento solo es responsable de la galactorrea en un 30% de los casos. A su vez, la toma de fármacos es la causa más frecuente de hiperprolactinemia. Durante el diagnóstico de galactorrea siempre se debe revisar la toma de fármacos con efecto hiperprolactinémico y determinar los valores de PRL y hormonas tiroideas. El tratamiento depende de la causa responsable.
Hipoplasia mamaria
Se observa en algunos hipogonadismos. La menopausia también puede ser causa de atrofia mamaria. En estos casos, el tratamiento cíclico con estrógenos y progestágenos puede revertir la atrofia. Un déficit total o parcial del desarrollo mamario también puede deberse a una disminución en la sensibilidad a los estrógenos y progestágenos, en cuyo caso no responde a dosis sustitutivas.
Enfermedad fibroquística
Es la afección mamaria benigna más frecuente. Consiste en la aparición de quistes y fibrosis en ambas mamas, en mujeres en edad fértil con clínica cíclica de predominio en la fase premenstrual. Desaparece tras la menopausia y su intensidad disminuye tras la gestación y la lactancia. No suele tratarse. Se mantiene una vigilancia activa periódica para tomar medidas quirúrgicas si se sospecha una posible malignización.