resumen
En este cuarto artículo de la serie Formulación magistral en Veterinaria se presentan algunas de las fórmulas que por vía tópica pueden resultar de interés tanto a los profesionales farmacéuticos formulistas como a los veterinarios.
En este caso, y dado que las formas de administración tópica son muy variadas, las fórmulas que se describen constituyen solo una pequeña muestra de las muchas alternativas posibles. Si bien es cierto que en el mercado existen numerosos productos destinados a ser administrados por esta vía, no se deben olvidar las ventajas que ofrece la formulación magistral, en cuanto a personalizar el preparado para cada animal y patología.
Además de las fórmulas de administración cutánea, al final del artículo también se citan algunos de los colirios y pomadas oftálmicas indicados para procesos inflamatorios, como queratoconjuntivitis seca infecciosa, ulceraciones corneales o glaucoma.
Principios activos y fórmulas tópicas
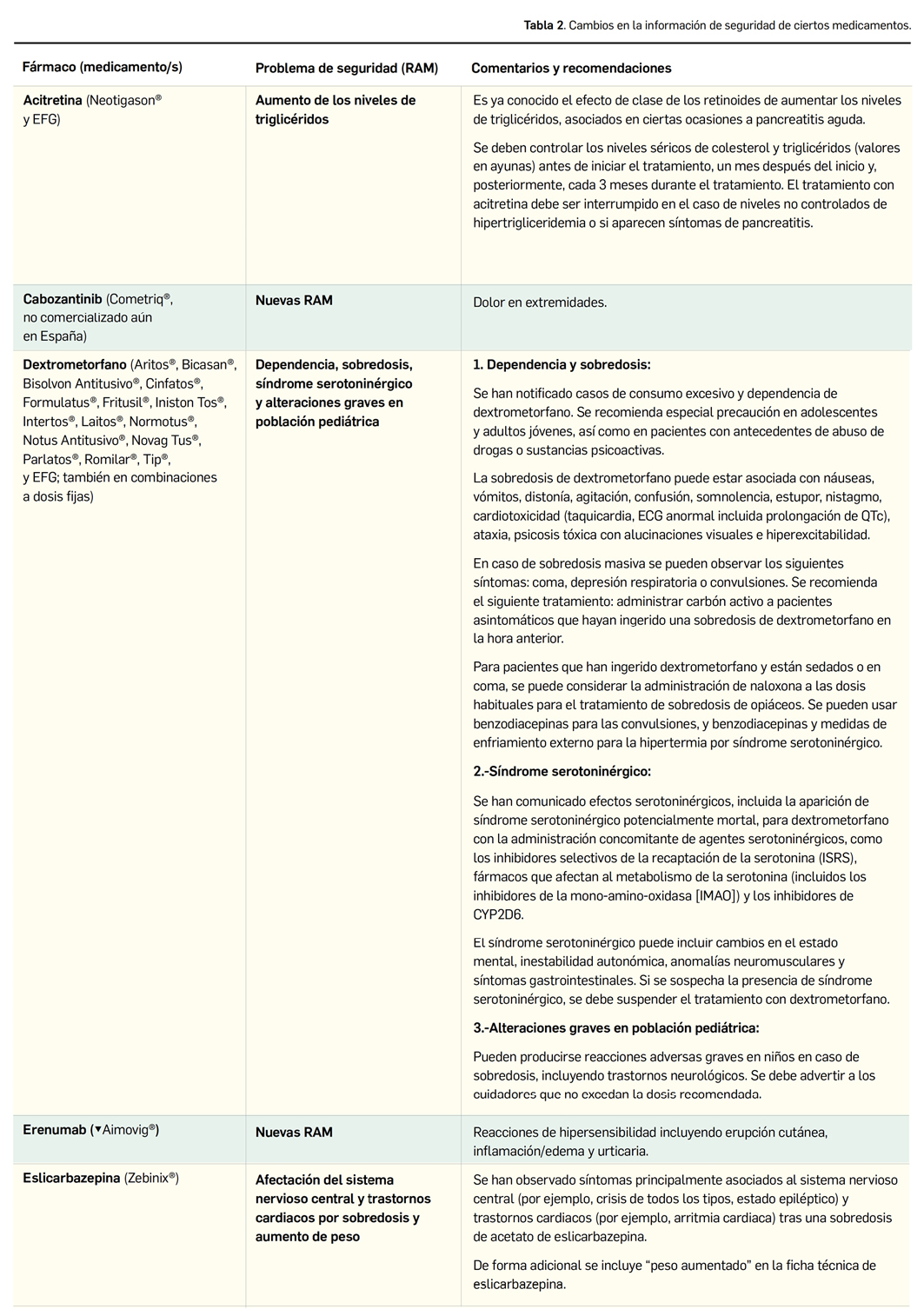
● Agua de Burow. Se utiliza por vía tópica diluida del 5 al 10%. Por su efecto astringente y antiséptico está indicada en dermatitis, piodermitis interdigital y de los puntos de apoyo e impétigo. Se recomienda aplicarla en forma de compresas humedecidas.
● Ácido láctico. Se trata de un alfa-hidroxiácido que forma parte del factor hidratante natural de la piel y juega un papel importante en el proceso de descamación del estrato córneo, controlando su correcto desarrollo y evitando la hiperqueratinización. Se utiliza por vía tópica en forma de gel o loción cremosa, del 0,5 al 5% como hidratante y del 5-15% como queratolítico.
Ejemplo de fórmula – champú emoliente:
Urea 10%
Ácido láctico 4,4%
Glicerina 5%
Detergente aniónico sulfonado
Tegobetaína L7® 10-15%
Texapon N-40®. 20-30%
Comperland KD 3%
Agua purificada c.s.p. 100ml
● Ácido salicílico. Puede emplearse como bacteriostático y fungicida y también por su acción queratolítica cuando se utiliza a concentraciones mayores del 2%.
Ejemplos de fórmulas:
Crema con urea y ácido salicílico: se emplea en el tratamiento de queratosis de los puntos de apoyo y queratosis seborreica, aplicándola una o dos veces al día.
Urea 10%
Ácido láctico 4,4%
Glicerina 5%
Lanolina 15%
Vaselina filante 20%
Alcohol estearílico 10%
Agua purificada c.s.p. 100g
Crema salicilada con hidrocortisona: está indicada en eczemas crónicos y se debe aplicar 2 o 3 veces al día
Ácido salicílico. 1%
Mentol. 0,5%
Hidrocortisona. 0,5%
Emulsión O/W
Neo PCL®………..………………25%
Propilenglicol…………………..5%
Agua purificada…..….c.s.p. 100g
Gel de baño queratolítico: además de ser útil para eliminar el exceso de sebo, posee acción descamativa gracias al ácido salicílico.
Ácido salicílico 2%
Detergente aniónico sulfonado
Tegobetaína L7® ………………….…10-15%
Texapon N-40®……………………20-30%
Comperland KD®. …………………..3%
Agua purificada…………….c.s.p. 100ml
Champú para dermatitis seborreica: ejerce acción queratolítica, queratoplástica, antipruriginosa y desengrasante, y está indicado en seborreas canina, equina y felina, cuando tratamientos previos con peróxido de benzoilo, azufre y ácido salicílico no han resultado eficaces.
Coaltar saponinado ……..…… 3%
Bioazufre líquido ……………. 2%
Ácido salicílico ……………… 2%
Triclosán …………….… 0,2-0,5%
Champú
Tegobetaína L7® 0-15%
Texapon N-40 20 %-30%
Agua purificada c.s.p. 100g
● Alantoína. Estimula la proliferación celular y presenta una ligera acción queratolítica, por lo que acelera la cicatrización de heridas, al mismo tiempo que ayuda a eliminar los tejidos necróticos. Puede asociarse a otros principios activos, por ejemplo a camomila, que aporta un efecto antiinflamatorio, analgésico, cicatrizante y antiséptico.
Crema cicatrizante de camomila:
Alantoína.…………………………………….0,5%
Alfa bisabolol.……………………………….0,2%
Extracto glicólico de camomila……….7%
Emulsión O/W
Neo PCL®………..…………….25%
Propilenglicol…………….…..5%
Agua purificada……c.s.p. 100g
● Benzoilo peróxido. Es un antiséptico local con propiedades queratolíticas y antimicrobianas frente a Staphylococus epidermis y Propionibacterium acnes. Está indicado en el tratamiento de la seborrea oleosa, acné, piodermitis, demodecosis y dermatosis marginal de la oreja.
En perros se suele utilizar en concentraciones del 2 al 5% y en gatos al 2,5%, en forma de loción o gel, aplicado de 2 a 3 veces al día. También se puede formular en champú o gel detergente para aplicarlo en forma de baños, generalmente cada tres días.
Loción de peróxido de benzoilo:
Peróxido de benzoilo ..2g
Propilenglicol 20g
Etanol 96º 50g
Agua purificada 30g
● Clorhexidina. Es un agente bactericida y fungicida de amplio espectro que se puede formular como solución, champú o jabón en concentraciones del 0,05 al 0,5%. Se suele asociar a la cetrimida para la desinfección de heridas y quemaduras. En odontología, se utiliza a dosis del 0,1 a 0,2% para evitar el acumulo de sarro, aplicándolo diariamente sobre las piezas dentales y encías con un algodón.
Loción de clorhexidina y cetrimida: se aplica con ayuda de una gasa o torunda de algodón sobre la zona a tratar, limpia y seca, 1 o 2 veces al día.
Clorhexidina digluconato solución 20% ……..…..0,5%
Cetrimida ….…0,5%
Etanol40º …..c.s.p. 100ml
Enjuague bucal con clorhexidina: se emplea humedeciendo un algodón pequeño y aplicándolo sobre dientes y encías del animal.
Clorhexidina digluconato solución 20% 0,2%
Saborizante c.s.
Agua purificada c.s.p. 100ml
● Clotrimazol. Como fungicida es eficaz en el tratamiento tópico de dermatofitosis localizadas y estomatosis por cándida. En perros y gatos se suelen utilizar las fórmulas de clotrimazol al 1% en crema, loción o solución tópica, a las cuales también se puede añadir betametasona dipropionato al 0,02% sumando una acción antiinflamatoria. Se recomienda aplicarlo 2 veces al día hasta una semana después de la remisión de los síntomas.
Crema de clotrimazol 1%:
Clotrimazol……………………………1%
Emulsión O/W
Neo PCL®………..…………25%
Propilenglicol………………5%
Agua purificada…..….c.s.p. 100g
Loción de clotrimazol 1%:
Clotrimazol 1%
Propilenglicol 20%
Etanol 96º 40%
Agua purificada c.s.p. 100 g
● Cobre sulfato. Actúa como astringente, bacteriostático y fungicida. Dado que se trata de una sal de un ácido fuerte, presenta propiedades caústicas débiles. Se utiliza en concentraciones del 0,1 al 2% en solución y resulta útil en el tratamiento del impétigo y en dermatitis exudativas y costrosas, aplicado localmente en baños o compresas.
Solución de sulfato de cobre 0,1%:
Sulfato de cobre pentahidratado…….0,1%
Agua purificada..……………………c.s.p. 100ml
● Eritromicina. Se emplea en el tratamiento de infecciones cutáneas por gérmenes sensibles a concentraciones del 1 al 3%, con una pauta de administración de una o dos veces diarias. También puede asociarse a otras sustancias como el peróxido de benzoilo para el tratamiento de dermatitis seborreica, con una pauta de 2 o 3 veces diarias, sin superar la concentración de 2,5% en felinos.
Gel de benzoilo peróxido 2% y eritromicina 2%:
Peróxido de benzoilo 2%
Eritromicina… 2%
Gel
Brij® 35 .5%
Etanol 96º 15%
Metilidenglicerol 15%
Hispagel® 40%
Agua purificada……. c.s.p. 100 ml
● Hidrocortisona. Este corticoesteroide de baja potencia se suele emplear en trastornos endocrinos, artritis reumática, asma, dermatitis alérgica, lupus, etc.
Loción de hidrocortisona 0,4%: está indicada en urticaria, con una pauta de una o dos veces al día.
Hidrocortisona 0,4%
Mentol. 0,05%
Loción lanette
Cera lanette N® 2,5%
Cetiol V 2,5%
Agua purificada c.s.p. 100g
● Ictiol. Antiséptico y antipruriginoso, indicado en el tratamiento de eczemas.
Crema de ácido salicílico 2% e ictiol 3%:
Ácido salicílico 2%
Ictiol 3%
Emulsión O/W
Neo PCL® 25%
Propilenglicol 5%
Agua purificada c.s.p. 100g
● Ketoconazol. Se emplea en el tratamiento de infecciones fúngicas, tanto superficiales como sistémicas. Por vía tópica se formula al 2% en champú y del 1 al 2% en cremas, lociones o soluciones. Se debe aplicar 1 o 2 veces al día sobre y alrededor de las zonas a tratar, previamente limpias y secas.
Champú de ketoconazol 2%:
Ketoconazol 2%
Champú
Tegobetaína L7® 10-15%
Texapon N-40®. 20-30%
Comperland KD® 3 %
Agua purificada .c.s.p. 100 ml
Crema de ketoconazol 1%::
Ketoconazol 2%
Champú
Tegobetaína L7® 10-15%
Texapon N-40® 20-30%
Comperland KD® 3 %
Agua purificada .c.s.p. 100 ml
● Licocaína. Se emplea, en forma de lidocaína base o clorhidrato, como anestésico tópico en piel y mucosas. La concentración más habitual es la del 2% en gel, solución o incluso en crema o loción, aunque dependiendo de la especie y la localización de la afección puede formularse del 0,5 al 10%. Cuando es necesario aplicar la fórmula en el interior de la boca se suele emplear el excipiente adhesivo oral.
Crema de lidocaína 2%: se recomienda aplicarla de 2 a 3 veces al día
Lidocaína clorhidrato 2%
Base de Beeler
Alcohol cetílico 5%
Cera blanca 1%
Propilenglicol 10%
Lauril sulfato sódico 2%
Agua purificada… c.s.p. 100g
Pasta bucal de lidocaína 2%: se puede aplicar hasta 3 veces al día.
Lidocaína clorhidrato 2%
Excipiente adhesivo ora c.s.p. 30g
La lidocaína también puede asociarse con prilocaína, ambas al 2%, dando lugar a una mezcla eutéctica (EMLA, por sus siglas en inglés) que, incorporada en un gel, se utiliza como anestésico para pequeñas intervenciones quirúrgicas.
Crema EMLA:
Prilocaína base 2%
Lidocaína base 2%
Sepigel® 305 3 %
Agua conservans.… c.s.p. 30 ml
● Mentol. Se utiliza tópicamente en casos de prurito y urticaria, ya que aporta sensación de frescor, lo que contribuye a que posea una ligera acción antiinflamatoria y descongestionante.
Mentol 0,1%
Alcanfor 0,5%
Extracto glicólico de camomila 3,5%
Gel
Etanol 96º 5%
Carbopol®. 1%
Trietanolamina c.s.p. pH 7
Agua purificada c.s.p. 100 ml
● Miconazol. Este fungicida de amplio espectro se utiliza en concentraciones del 1 al 3% en el tratamiento de dermatofitosis, pitirosporosis, candidiasis mucocutánea, genital o auricular. Se emplea al 2% en dermatofitosis y pitirosporosis, generalmente en emulsión.
Crema de miconazol 2%:
Miconazol… .2%
Emulsión O/W
Neo PCL® 25%
Propilenglicol 5%
Agua purificada .c.s.p. 100g
● Nistatina. En forma de suspensión oral se utiliza en el tratamiento de candidiasis gastrointestinales en perros y gatos, con una dosis de 100.000 UI, cada 6 horas, administrando 20 gotas/10 kg de peso animal, durante 20 días. Por vía tópica está indicada en infecciones de Candida spp. en forma de emulsión, con una dosis de 100.000 UI por gramo.
Emulsión de nistatina 100.000 UI/g:
Nistatina.……………………………….100.000 UI/g
Emulsión O/W
Neo PCL® ………..…………25%
Propilenglico 5%
Agua purificada .c.s.p. 100g
● Permanganato potásico. Es un agente oxidante con acción antiséptica, desodorante y ligeramente astringente que está indicado en dermatosis exudativas de origen infeccioso o sobreinfectadas. Se formula en concentraciones de 1/5.000 a 1/20.000 en solución acuosa y en condiciones óptimas de conservación presenta una caducidad de solo 7 días.
Solución acuosa de permanganato potásico 1/10.000: se recomienda aplicarla 3 o 4 veces al día sobre la zona a tratar con ayuda de una gasa o torunda de algodón.
Permanganato potásico .0,01%
Agua purificada c.s.p. 100 ml
● Urea. Su indicación más habitual es la hiperqueratosis de los puntos de apoyo (articulaciones, húmero, radio, tarso, tibia, fibulares, etc.). En concentraciones del 5 al 10% es hidratante y del 10 al 30% actúa como queratolítico. Se suele formular en crema, loción oleosa o pomada.
Urea 20% en emulsión: se recomienda aplicarla 2 veces al día sobre los puntos de apoyo del animal para eliminar las queratosidades.
Urea………………………………….20%
Emulsión O/W
Neo PCL® ………..…………25%
Propilenglico 5%
Agua purificada .c.s.p. 100g
Asociada a timol puede utilizarse para el tratamiento de onicomicosis, en cuyo caso se debe aplicar de de 2 a 4 veces diarias en las uñas afectadas:
Timol 2g
Urea 16g
Alcohol 25g
Propilenglicol 35g
Agua purificada c.s.p. 100g
● Zinc óxido. Por su efecto antiséptico y astringente está indicado en el tratamiento de dermatosis pruriginosas, y también como cicatrizante en heridas y úlceras. En gatos, perros y caballos se utiliza en concentraciones del 2 al 20%. También forma parte de la pomada de Milian, fórmula clásica que se empleaba para el tratamiento de la sarna sarcóptica, notoédrica, psoróptica y corióptica y cuya pauta de aplicación recomendada es de una o dos veces al día.
Pomada de Milian:
Zinc óxido 0,5%
Potasio sulfato 2,5%
Agua purificada 2,5%
Lanolina 50%
Vaselina filante c.s.p. 100g
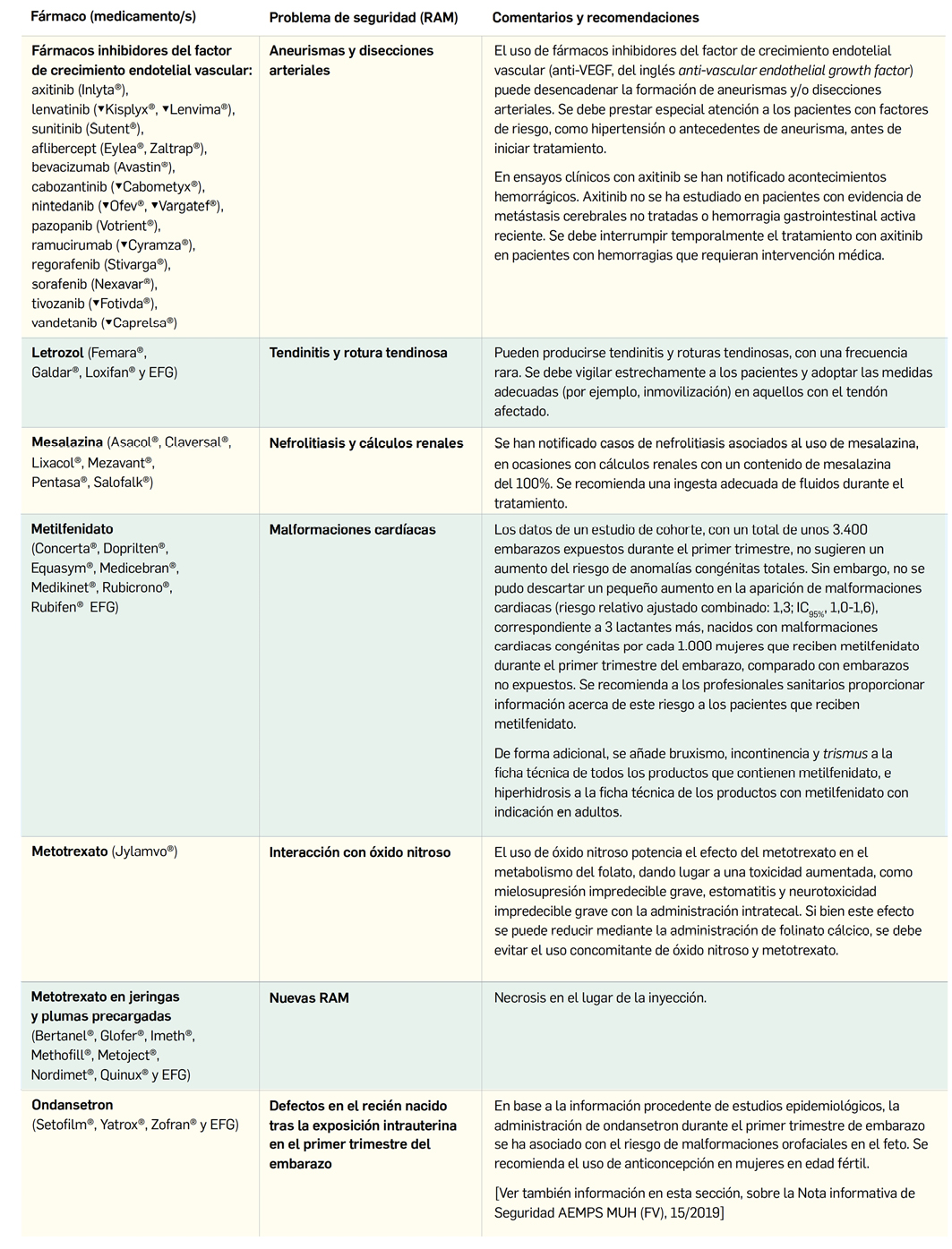
Polvos y pastas tópicas
Los polvos tópicos se pueden emplear por su efecto secante y lubrificante de zonas intertriginosas. Se pueden destacar las siguientes.
Polvo secante con propiedades bacteriostática y fungicida, indicado en ulceraciones dolorosas, con una posología habitual de 2 a 3 aplicaciones diarias en uso externo:
Ácido salicílico
Ácido bórico
Óxido de zinc
Almidón
Talco………….aa 20g
Fórmula con acción acaricida. El yodoformo posee acción antiséptica y se emplea al 20% en el tratamiento de miasis cutáneas y óticas en bovinos, ovinos, caprinos, cerdos, caballos, perros, gatos y aves. La posología habitual es de 2 a 3 veces diarias en uso externo.
Ácido bórico .10 g
Óxido de zinc 10 g
Yodoformo .5 g
Pasta al agua: está indicada en dermatitis pruriginosas y quemaduras por su acción antipruriginosa, astringente y antiséptica. La posología habitual es de 2 a 3 veces diarias en uso externo. Se puede formular con hidrocortisona al 1,5% para conseguir una acción antiinflamatoria y/o con mentol al 0,1% para conseguir una acción antiséptica y analgésica local.
Óxido de zinc 25g
Talco 25g
Glicerina 25ml
Agua purificada c.s.p. 100ml
Fórmulas de aplicación en la zona auricular
Como ya se comentó en el primer artículo de esta serie, las características anatómicas y las costumbres de los animales, como el rascado o las peleas, implican que este grupo de fórmulas resulten muy útiles en el campo de la veterinaria.
Las formas farmacéuticas adecuadas para esta vía van desde gotas óticas o irrigaciones a polvos, pasando por las semisólidas como cremas o pomadas. Entre las indicaciones habituales se encuentran la otitis, los eczemas o los tapones de cerumen, aunque también pueden utilizarse simplemente para la higiene adecuada de la zona.
Fórmulas para higiene auricular: acción cerumenolítica, higienizante y antiséptica.
Trietanolamina 1%
Sodio bicarbonato 5%
Glicerina 15%
Agua purificada c.s.p. 100g
Se aplica previamente a la administración de medicamentos por vía ótica, para realizar una adecuada higiene auricular. La trietanolamina contribuye a reblandecer y facilita la eliminación del cerumen, a la vez que ejerce una acción bacteriostática. Por su parte, el bicarbonato sódico, además de cerumenolítico, es antipruriginoso, y la glicerina, que se emplea para incrementar la viscosidad, también puede contribuir a reblandecer el cerumen. Se recomienda aplicar semanalmente, con ayuda de un bastoncillo o torunda de algodón.
Adicionalmente, el bicarbonato sódico también se puede formular al 10% para la eliminación de tapones de cerumen. La dosis habitual es 1 o 2 aplicaciones del preparado durante 7 días.
Sodio bicarbonato. 10%
Cetiol® V c.s.p. 30ml
Ácido salicílico 0,5% y ácido láctico 10% en gotas óticas: a estas concentraciones el ácido salicílico se comporta como queratoplástico y, asociado al láctico, regula el proceso de descamación fisiológico del estrato córneo, controlando su correcto desarrollo y evitando la hiperqueratinización. Además, esta fórmula presenta un efecto antimicrobiano. La posología habitual es 10 gotas dos veces al día.
Ácido salicílico 0,5%
Ácido láctico 10%
Solución otológica
Propilenglicol 10%
Glicerina 30%
Etanol 70º 60%
Fórmulas con acción antimicrobiana
Miconazol 1% en solución otológica: se utiliza para el tratamiento de otitis fúngica con una pauta de 2 a 12 gotas cada 12 o 24 horas, que debe mantenerse hasta 2 semanas después de la curación clínica y/o de que los cultivos sean negativos.
Miconazol 1%
Solución otológica
Propilenglicol 10%
Glicerina 30%
Etanol 70º 60%
Fluocinolona 0,03% y miconazol 2% gotas óticas: en ocasiones puede resultar útil asociar un corticoide, aunque debe tenerse en cuenta que por su acción inmunodepresora puede disminuir la eficacia antifúngica y favorecer la sobreinfección bacteriana.
Fluocinolona acetónido 0,03%
Miconazol 2%
Solución otológica
Propilenglicol 10%
Glicerina 30%
Etanol 70º 60%
Fusidato sódico 2% y triamcinolona acetónido 0,05% en emulsión O/W: está indicada en el tratamiento de infecciones por estafilococos y otras bacterias Gram positivas. Al presentar una consistencia de crema con alto contenido acuoso, resulta especialmente adecuada para su aplicación en el pabellón auricular. Tal y como sucede en la fórmula anterior, la asociación con un corticoide puede disminuir la eficacia antimicrobiana, aunque resulta muy útil para controlar la inflamación. La posología habitual es de 1 a 3 aplicaciones diarias.
Triamcinolona acetónido………..0,05%
Fusidato sódico……………………….2%
Emulsión O/W
Neo PCL® 25%
Propilenglicol 5%
Agua purificada c.s.p. 100g
Fórmulas con acción analgésica y antiinflamatoria
Prednisolona 2% y lidocaína 8% en gotas óticas: se emplea en otitis externas no infecciosas y se recomienda la instilación de 5 a 10 gotas, dos veces al día.
Prednisolona… 2%
Lidocaína clorhidrato 2%
Solución otológica
Propilenglico 10%
Glicerina 30%
Etanol 70º 60%
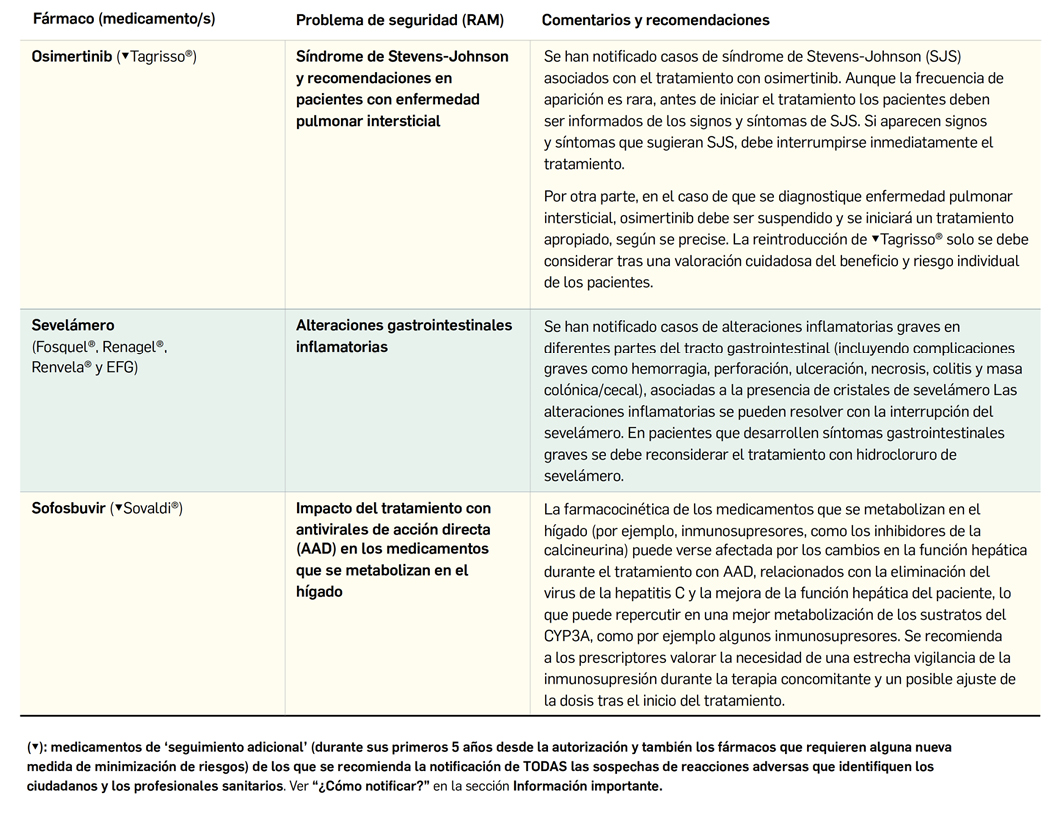
Colirios y pomadas oftálmicas
Por último, se describen dos de los colirios más prescritos en formulación magistral veterinaria para procesos inflamatorios, como queratoconjuntivitis seca infecciosa, ulceraciones corneales o glaucoma.
Ciclosporina (del 1 al 2%). Inmunosupresor con propiedades lacrimomiméticas y antiinflamatorias. Utilizado en el tratamiento de queratoconjuntivitis idiopática seca crónica en perros en forma de colirio o pomada.
Tacrólimus (0,015 a 0,03%). Inmonumodulador y lacrimomimético indicado en procesos asociados a la infiltración conjuntival y/o corneal de linfocitos y células plasmáticas, como el pannus, las queratoconjuntivitis infiltrativas inmunomoduladoras, síndrome del ojo seco y las episcleritis nodulares y necrotizantes en perros, gatos y caballos. Formulado en colirio y pomada. Se puede asociar a ciclosporina.
Ambos se encuentran descritos en el artículo de colirios (2ª parte) publicado en el número 416 de Panorama Actual del Medicamento.
Agradecimientos
A Juan del Arco, Mª Ángeles de Diego, Sonia Sanz, Amaia Monasterio y Ainhoa Bilbao, miembros del grupo Higea del COFBi,
y a Helena Barroso, veterinaria de Sopelana, por sus sugerencias y colaboración en la revisión de este artículo.