El pasado 25 de octubre se hizo pública1 la memoria anual de actividades de la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) para el año 2022. Por su interés sanitario y profesional, recogemos a continuación una selección de los datos más relevantes contenidos en la misma.
Con la pandemia por COVID-19 ya bajo control gracias al éxito de los programas de vacunación, buena parte del trabajo de la AEMPS durante el 2022 se ha concentrado en la puesta en marcha de acciones encaminadas a minimizar el impacto que futuras crisis puedan ocasionar en el ámbito del medicamento. En este sentido, el fortalecimiento de la producción nacional de medicamentos y la consecuente reducción de la dependencia de otros países resultan claves para garantizar un adecuado suministro, un aspecto que continúa representando en la actualidad un elemento de vulnerabilidad para el sistema sanitario.
Una de las acciones más destacadas a este respecto ha consistido en la elaboración de un listado de medicamentos estratégicos, integrado por aquellos medicamentos considerados críticos debido a su necesidad para la atención básica de la salud o bien por su vulnerabilidad dentro de la cadena de suministro, y que por lo tanto requieren de medidas concretas de tipo regulatorio o económico para garantizar su mantenimiento en el mercado. El principal factor de vulnerabilidad identificado ha sido la escasa representación –por ejemplo, por el hecho de haber solo uno o dos medicamentos autorizados–, aunque también se han considerado otros como los casos de medicamentos para los que no se dispone de alternativa terapéutica en el mercado, aquellos que cuentan con escasos fabricantes o aquellos que han sufrido problemas de suministro continuados. El listado, aunque sujeto a nuevas incorporaciones dentro de un marco dinámico, está constituido por ahora por 541 medicamentos que contienen 295 principios activos diferentes, con una importante presencia de medicamentos pertenecientes a los grupos de antiinfecciosos para uso sistémico –grupo J de la clasificación ATC– y de los medicamentos del sistema nervioso –grupo N–.
Entre las medidas que la AEMPS ha implementado para garantizar la comercialización de estos medicamentos estratégicos destacan la agilización de trámites administrativos y regulatorios –por ejemplo, con menores plazos para la validación de solicitudes– o el ofrecimiento de asesoramiento científico y regulatorio al laboratorio farmacéutico que vaya a presentar un dosier de registro de un medicamento incluido en este listado.
Los problemas de suministro de medicamentos, estratégicos o no, se han agudizado en el último año como consecuencia de distintos factores, entre los que destacan el repunte de infecciones respiratorias, la crisis energética o el notable aumento de la inflación. La complejidad y el carácter internacional de muchas de las causas identificadas de los problemas de suministro hace especialmente importante la colaboración entre distintas agencias y organismos con el objetivo de plantear soluciones globales que vayan más allá de las alternativas que se puedan ofrecer ante un caso concreto. Por ello, la AEMPS ha reforzado la relación con entidades como la International Society for Pharmaceutical Engineering o Parental Drug Association.
Precisamente en este ámbito internacional, durante 2022 se han iniciado diversos proyectos de I+D+i en los que la Agencia española ha formado parte. Entre ellos, cabe destacar por ejemplo el proyecto europeo ACT EU, cuyo objetivo es situar a la Unión Europea como centro de la investigación clínica, o el proyecto EU4H11, también a nivel europeo, que promueve el trabajo conjunto en materia de formación de inspectores de normas de correcta fabricación.
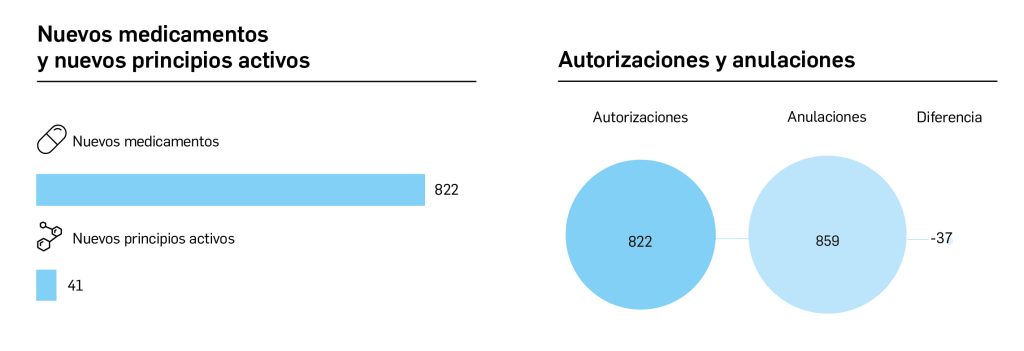
Con respecto a sus funciones más habituales, en 2022 la Agencia autorizó 2202 medicamentos de uso humano (más del 60% de ellos por procedimiento nacional), a partir de 2316 solicitudes recibidas y revisadas. Se rompe, por tanto, la tendencia descendente en la cifra de aprobaciones (en 2019 fueron 1357, en 2020, 1299 y en 2021 fueron 1161). La situación actual del mercado de medicamentos a final de 2022 viene definida por 20 661 medicamentos autorizados (el 64,7% sujetos a receta médica, un 15,4% de uso hospitalario, un 7,7% de diagnóstico hospitalario y un 12% sin prescripción), que totalizan 56 779 presentaciones – un aumento importante desde las 32 279 disponibles en 2021 debido a la inclusión de los medicamentos homeopáticos–, y 345 medicamentos suspendidos temporalmente.
En el ámbito de la investigación, la AEMPS autorizó el año pasado la realización de 923 ensayos clínicos con medicamentos de uso humano en España (cifra solo ligeramente inferior al año previo, en que se aprobaron 996 ensayos clínicos), de los cuales 172 se dirigieron a población pediátrica. La mayoría de ellos se enmarcan en el gran grupo de patologías oncológicas (40,1%), claramente destacado sobre otras áreas terapéuticas, seguido muy de lejos por enfermedades del sistema nervioso (8,5%) o enfermedades del sistema inmunitario (8,4%). Debido a la disminución de la gravedad de la crisis sanitaria ocasionada por la COVID-19, los ensayos clínicos autorizados relacionados con enfermedades víricas han pasado de representar el 8,6% en 2021 al 5,7% en 2022.
Si se centra el foco en los medicamentos de uso humano en relación a la COVID-19, se puede destacar que se autorizaron en 2021 un total de 8372 solicitudes de medicamentos en investigación frente al SARS-CoV-2. Esta cifra descendió en 2022 hasta las 3878 autorizaciones, mientras que el número de solicitudes canceladas pasó de 163 en 2021 a 561 en 2022.
En cuanto a las actuaciones de control de mercado de medicamentos de uso humano, la Agencia investigó un total de 347 denuncias por problemas de calidad. En 2022 se produjeron 34 retiradas por problemas de calidad, principalmente de clase II (25 de las 34). Por otro lado, la AEMPS realizó un esfuerzo importante en asegurar la garantía de disponibilidad en el mercado de los medicamentos y, para resolver los problemas de suministro que se iban presentando, realizó un total de 786 actuaciones con el objetivo de atenuar el impacto de la falta del medicamento hasta el restablecimiento de suministro; entre esas actuaciones destacan la comercialización excepcional (466 veces), el contacto con el laboratorio titular de autorización de comercialización del medicamento alternativo (206 veces), la interrupción de la exportación a terceros países (62 veces) o la importación de medicamento extranjero (35 veces).
Los Laboratorios Oficiales de Control de Medicamentos (OMCL) de la AEMPS siguen siendo uno de los pilares de las garantías que asegura la AEMPS en la evaluación y autorización de medicamentos de uso humano; su actividad es básica tanto en las campañas de control de mercado como en las actuaciones frente a los medicamentos falsificados. Durante el año 2022 analizaron un total de 83 518 muestras de posible tráfico ilícito de estupefacientes y psicótropos, y se realizaron 62 inspecciones internacionales de normas de correcta fabricación y buenas prácticas de distribución. En relación con la venta online de medicamentos, es preciso subrayar que se investigaron 65 páginas web y se retiraron hasta 383 anuncios alojados en plataformas y redes sociales.
En el área de los medicamentos veterinarios, en 2022 la AEMPS autorizó la comercialización de 97 medicamentos nuevos (cifra con escasa variación respecto a los 100 autorizados en 2021), en su mayoría (72,2%) por procedimientos de reconocimiento mutuo/descentralizado, y resolvió 2310 variaciones de autorizaciones de comercialización. El mercado actual de medicamentos veterinarios en España consta de 2457 medicamentos aprobados (68 más que en 2021) y 483 suspendidos temporalmente (el motivo principal es la falta de interés comercial por parte del titular), con un total de 4963 presentaciones comerciales. Asimismo, durante 2022 se recibieron y analizaron 4496 notificaciones individuales de sospechas de efectos adversos por este tipo de medicamentos. La AEMPS autorizó la realización de 15 ensayos clínicos con medicamentos veterinarios, siendo las especies más frecuentemente investigadas los perros (40%) y cerdos y aves (ambos 26,7%).
El sector de los medicamentos veterinarios es estratégico para garantizar el suministro de alimentos a la población, mantener el estatus sanitario de las explotaciones y evitar la transmisión de enfermedades a las personas. Por este motivo, desde el inicio de la pandemia, se decidió, tanto a nivel europeo como nacional, proporcionar cierta flexibilidad a estos medicamentos para permitir su fabricación y distribución continuada, con una interrupción mínima y sin afectar a su disponibilidad y sus estándares europeos de calidad, seguridad y eficacia. Cabe destacar que la AEMPS autorizó en 2022 un total de 936 importaciones excepcionales por vacío terapéutico.
Por otra parte, la AEMPS ha continuado dedicando esfuerzos para reducir el riesgo de selección y diseminación de resistencias a los antibióticos y mitigar así el impacto de este problema global sobre la salud de las personas y los animales, preservando de manera sostenible la efectividad de los antibióticos existentes, uno de los aspectos de mayor trascendencia a nivel mundial. Según los datos del Plan Nacional frente a la Resistencia a los Antibióticos (PRAN), en 2022 el consumo de antibióticos en salud humana en España había mostrado un 25,5% de reducción de su consumo respecto al periodo 2014-2021. En el ámbito de la sanidad animal, el PRAN ha trabajado en reforzar los mensajes que subrayaban la importancia del concepto One Health (“Una única salud”) para el mejor abordaje de futuras pandemias, lo que se ha reflejado en una reducción del 62,5% en el consumo de antibióticos de uso veterinario respecto a ese mismo periodo.
Durante el pasado año se recibieron y evaluaron 15 173 notificaciones al Sistema de Vigilancia de Productos Sanitarios (una proporción notablemente superior a las 9790 de 2021) y 547 notificaciones a través de NotificaPS, de las cuales 403 fueron enviadas por profesionales sanitarios y 144 por pacientes/usuarios. La AEMPS realizó 1009 acciones correctivas de seguridad, que dieron lugar a 588 alertas y 26 notas de seguridad. Del conjunto de notificaciones recibidas al Sistema de Vigilancia de Productos Sanitarios, 6555 corresponden a productos electromédicos o mecánicos, 4806 a implantes no activos, 1882 a productos no implantables, 1575 a implantes activos y 355 a productos de diagnóstico in vitro. En control del mercado, se evaluaron 110 casos de no conformidades detectadas. En este ámbito, la AEMPS es el Organismo Notificado 0318 (designado por el Ministerio de Sanidad); a 31 de diciembre de 2022, había emitido 214 nuevas autorizaciones de empresas con certificados en vigor para la importación y fabricación, así como 1004 modificaciones.
Asimismo, autorizó un total de 100 investigaciones clínicas con productos sanitarios.
Por último, durante 2022 la AEMPS autorizó 36 nuevos productos de cuidado personal (en su mayoría, productos de estética) y 76 productos biocidas entre desinfectantes para piel sana y repelentes de insectos. A lo largo del año, se recibieron 19 notificaciones de efectos no deseados de cosméticos, de las cuales se aceptaron 18 y, como parte de las actividades de control de mercado, se evaluaron 519 casos.
Archive
Revista PAM: 469
Número 469, Diciembre 2023
Medicamentos con nuevos principios activos o biosimilares
Valoración de la innovación terapéutica en PAM
Es importante indicar que se valora el grado de innovación. Todos los medicamentos, sean innovadores o no, tienen utilidad terapéutica, en tanto que su autorización por las autoridades sanitarias implica que han demostrado rigurosamente su eficacia, su seguridad, su calidad y las condiciones de uso (incluyendo la información contenida en la ficha técnica – sumario de características – y en el prospecto del medicamento). Por tanto, la valoración que se hace se refiere a la incorporación, en el grado que se determine, de algún elemento innovador con respecto a otros medicamentos autorizados previamente para iguales o similares indicaciones terapéuticas o, en su caso, cubriendo la ausencia de éstas.
Asimismo, debe considerarse que ésta es una evaluación que se practica coincidiendo con la comercialización inicial del medicamento. Se trata, por consiguiente, de una valoración provisional de la innovación realizada en función de la evidencia clínica disponible hasta el momento, , lo que no prejuzga, en ningún caso, la disponibilidad posterior de nuevas evidencias científicas (de eficacia o de seguridad) en la indicación autorizada o el potencial desarrollo y autorización, en su caso, de nuevas indicaciones terapéuticas o la imposición de restricciones de uso en las anteriores.
Se consideran tres posibles niveles, adjudicados en función de la relevancia de la(s) innovación(es) presentes en el nuevo medicamento, siempre en relación al arsenal terapéutico disponible clínicamente en España en el momento de la comercialización:
- SIN INNOVACIÓN (*). No implica aparentemente ninguna mejora farmacológica ni clínica en el tratamiento de las indicaciones autorizadas.
- INNOVACIÓN MODERADA (**). Aporta algunas mejoras, pero no implica cambios sustanciales en la terapéutica estándar.
- INNOVACIÓN IMPORTANTE (***). Aportación sustancial a la terapéutica estándar.
Se distinguen dos niveles de evidencia científica para los aspectos innovadores de los nuevos medicamentos:
- Evidencia clínica: mediante estudios controlados, específicamente diseñados y desarrollados para demostrar la eficacia y la seguridad del nuevo medicamento, con demostración fehaciente de lo que puede ser un avance o mejora sobre la terapia estándar hasta ese momento, en el que caso de que exista.
- Plausibilidad científica (potencialidad): existencia de aspectos en el medicamento que teórica y racionalmente podrían mejorar la terapéutica actual, pero que no han sido adecuadamente demostrados mediante ensayos clínicos, bien por motivos éticos o bien por imposibilidad de realización en el momento de la comercialización del nuevo medicamento: perfil de interacciones, mecanismos nuevos que permiten nuevas vías terapéuticas, nuevos perfiles bioquímicos frente a mecanismos de resistencia microbiana, posibilidad de combinar con otros medicamentos para la misma indicación terapéutica, efectos sobre el cumplimiento terapéutico (por mejoras en la vía, número de administraciones diarias, etc.), mejora de la eficiencia económica, etc.
El rigor de los datos contrastados mediante ensayos clínicos controlados (evidencia clínica) es determinante en la valoración de la innovación, mientras que las potencialidades solo pueden ser valoradas accesoriamente, como aspectos complementarios de esta valoración. En ningún caso, un medicamento es valorado con un nivel de innovación importante en función de sus ventajas potenciales, si no aporta otras ventajas demostradas clínicamente. Se analizan cinco aspectos de la innovación: clínica, molecular, toxicológica, físico-química y económico-tecnológica. Como ya se ha indicado, la fundamental y determinante es la novedad clínica.
Estadística de altas y bajas, composición, precio y características de medicamentos
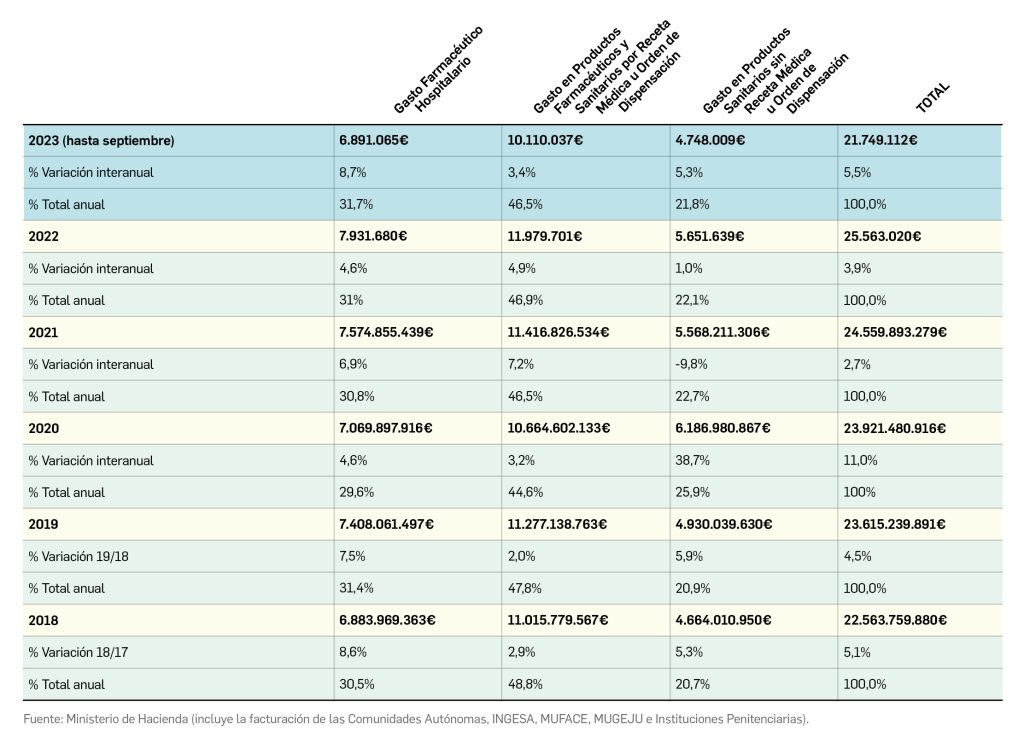
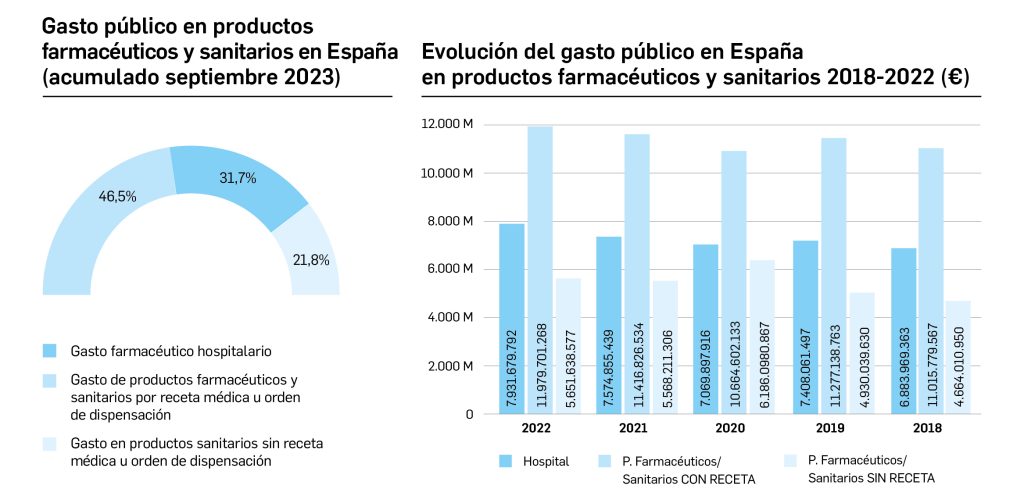
Gasto público en productos farmacéuticos y sanitarios en España
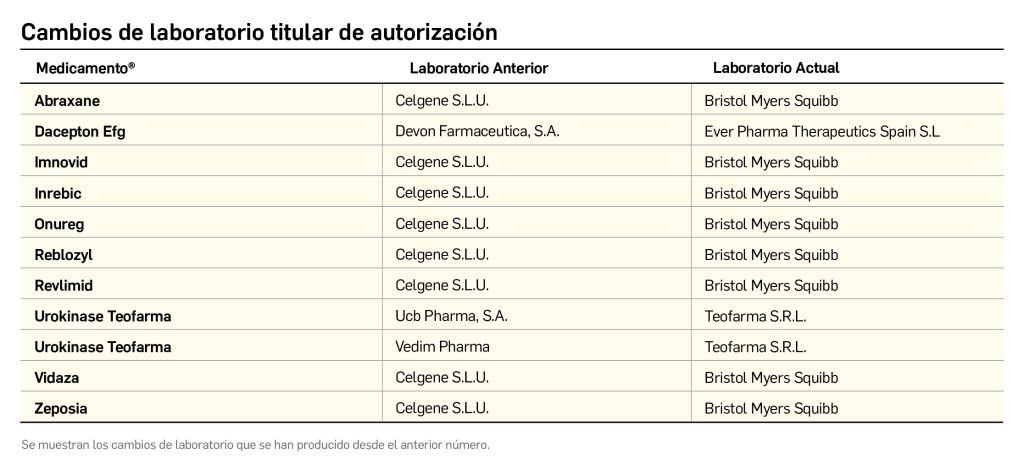
Variaciones en medicamentos previamente comercializados
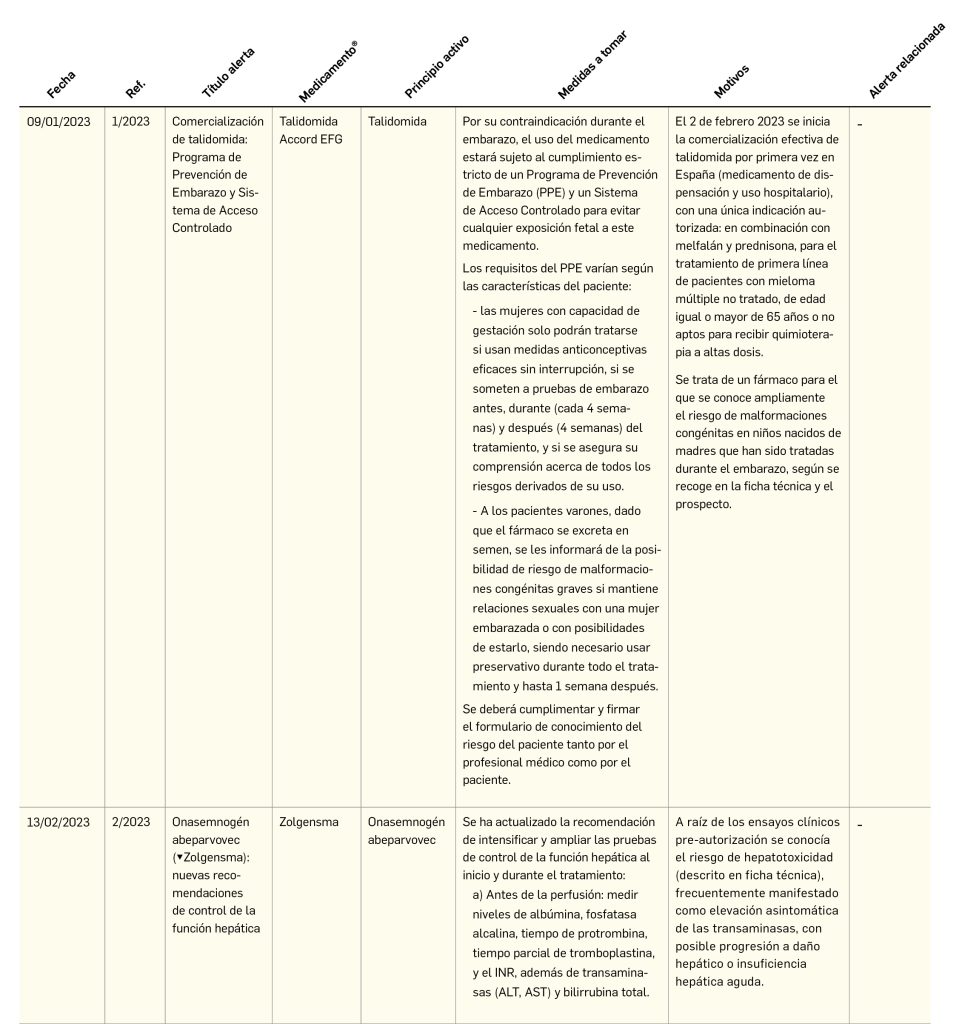
Alertas de seguridad
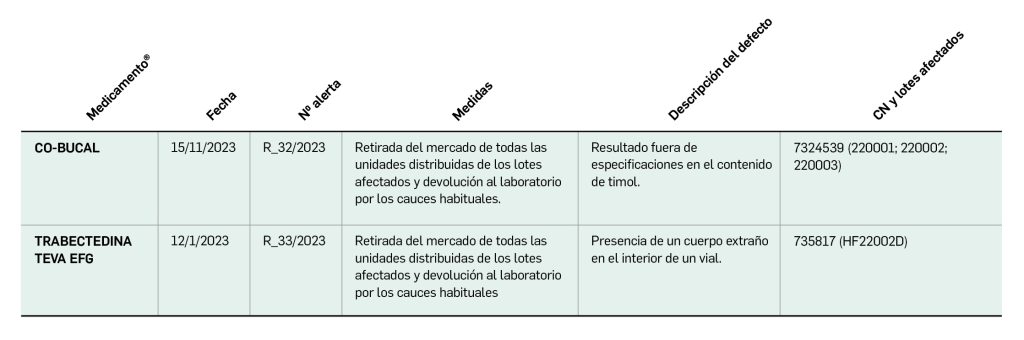
Alertas de calidad
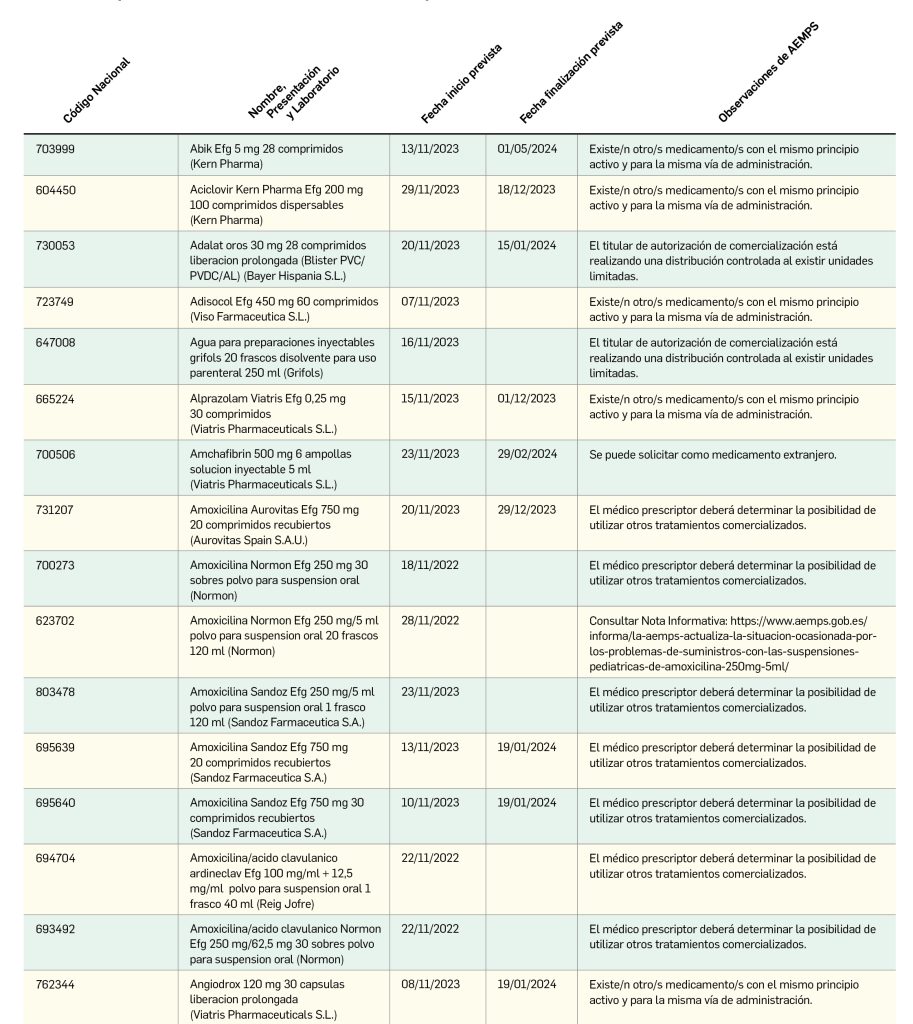
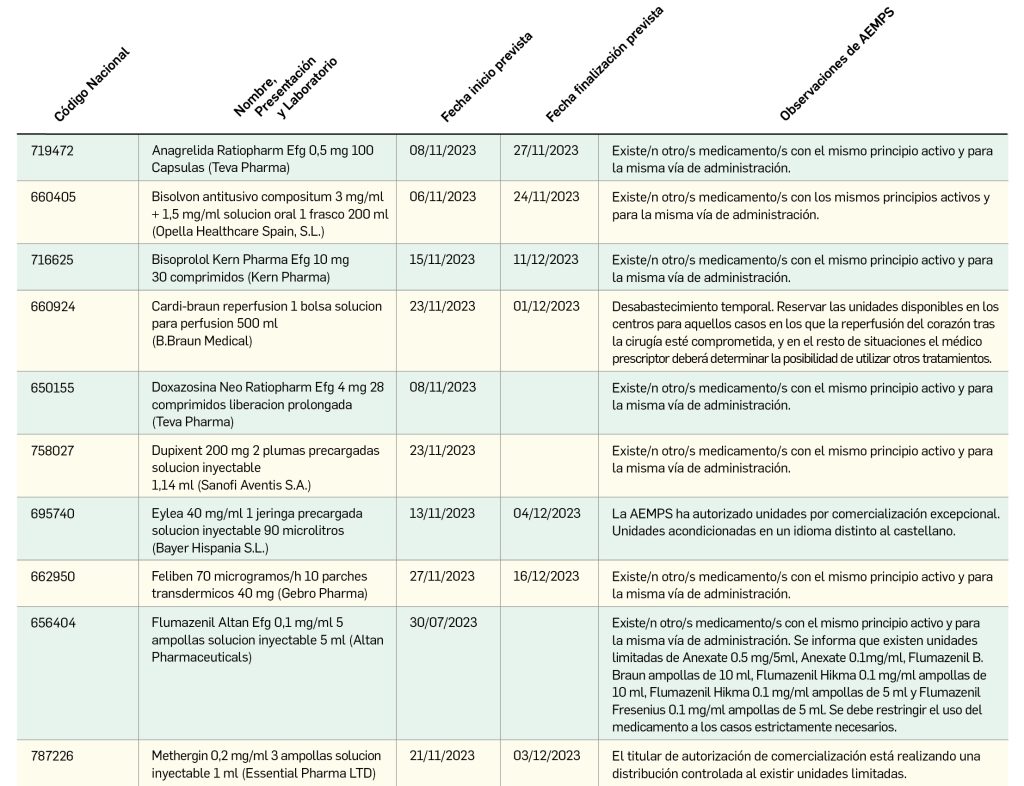
Nuevos problemas de suministro
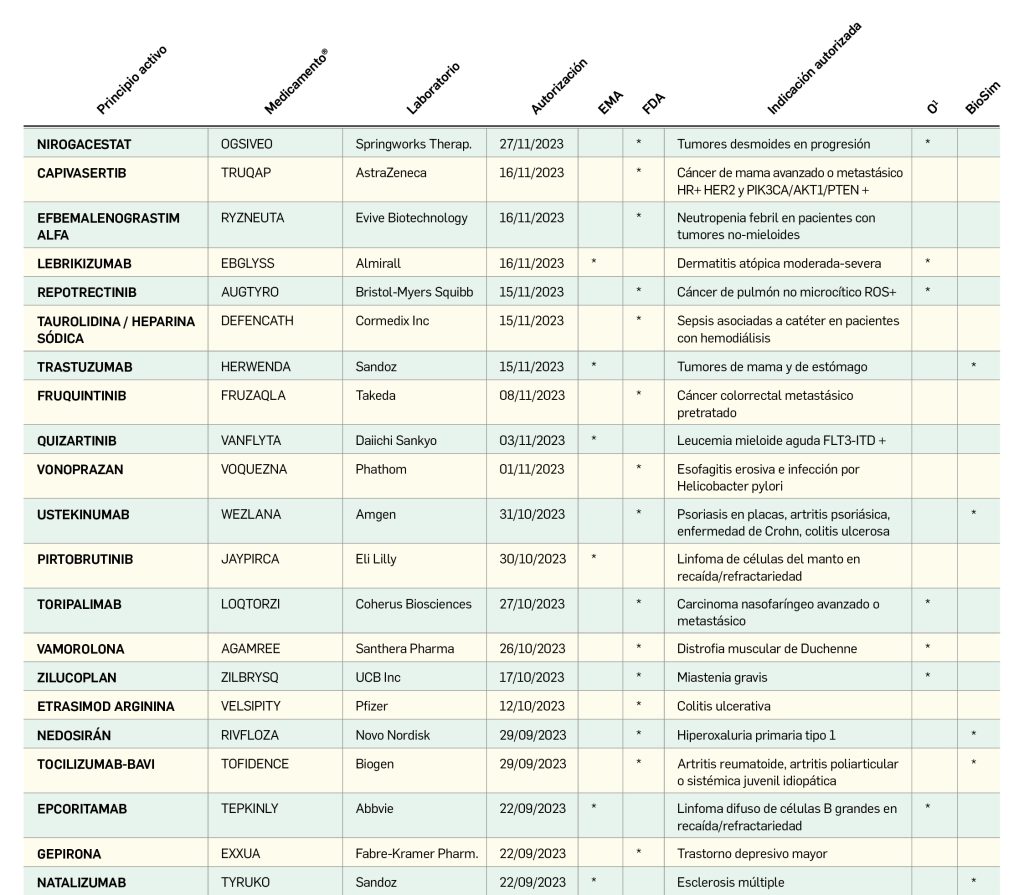
Medicamentos de uso humano autorizados en la Unión Europea (EMA) y Estados Unidos (FDA)
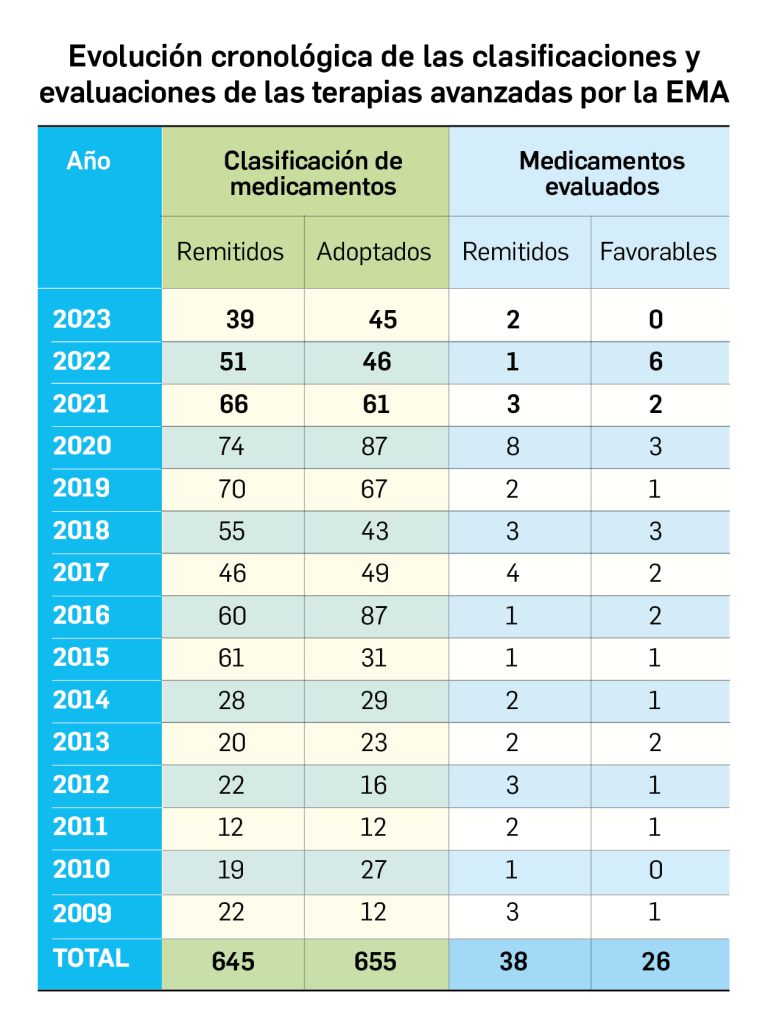
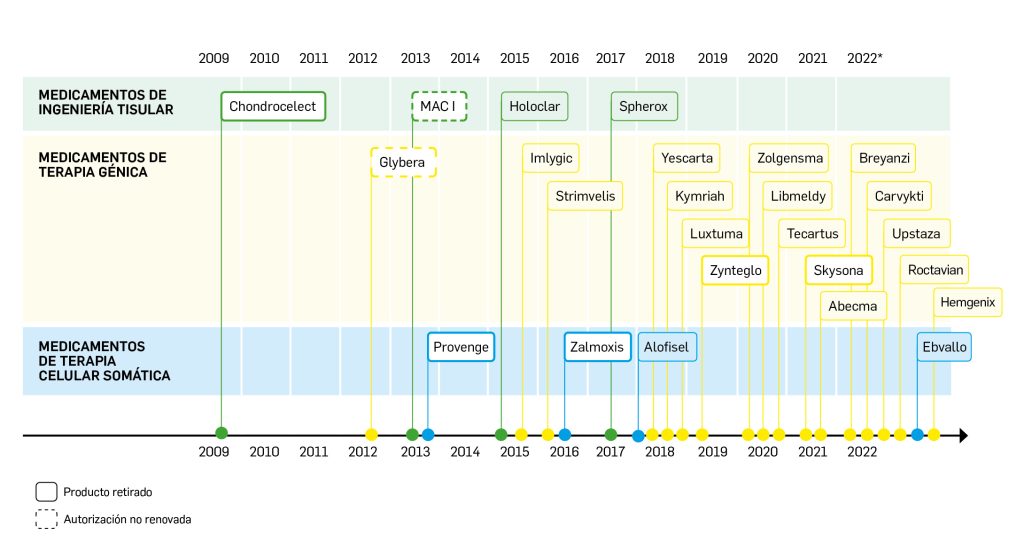
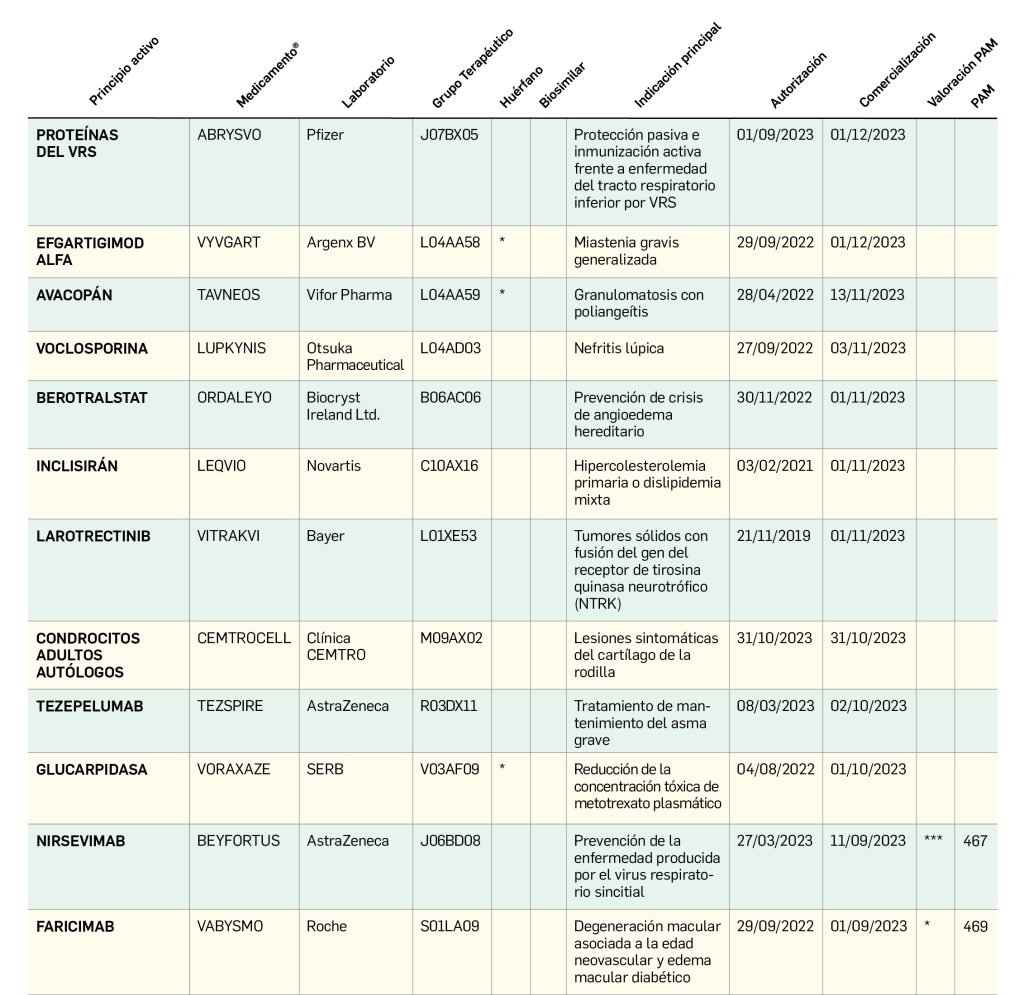
Nuevos medicamentos de terapias avanzadas
Los medicamentos de terapia avanzada (MTA o Advanced Therapy Medicinal Products, ATMP) ofrecen nuevos e innovadores tratamientos para las enfermedades. Están basados en la terapia génica, la terapia celular somática o la ingeniería tisular. El marco legal para las ATMP en la Unión Europea está establecido en la Regulation (EC) No 1394/2007 on advanced therapy medicinal products que asegura el libre movimiento de estas medicinas dentro de la Unión Europea y el acceso a los mercados. La regulación (EC) nº 1394/2007 también establece el nuevo Comité en Terapias avanzadas (CAT) cuya responsabilidad fundamental consiste en preparar un proyecto de opinión sobre cada nueva solicitud de medicamento de terapia avanzada planteada a la Agencia Europea de Medicamentos, antes de que el Comité de Medicamentos de Uso Humano (CHMP, Committee for Medicinal Products for Human Use) de la misma adopte una opinión definitiva sobre la concesión, modificación, suspensión o revocación de una autorización de comercialización para el medicamento en cuestión.
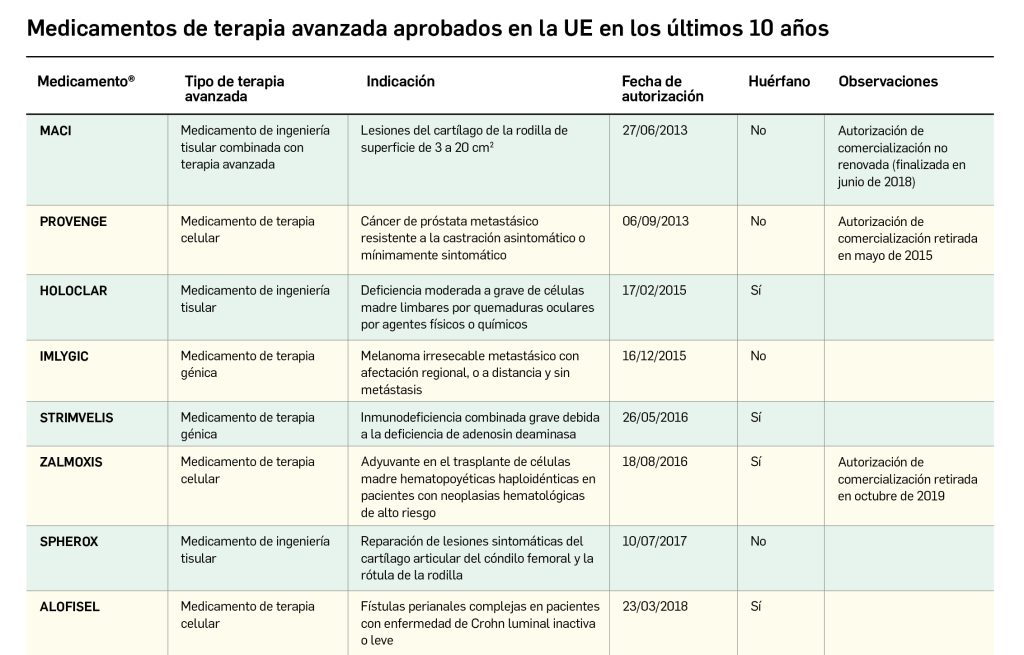
La siguiente tabla recoge los medicamentos de terapia avanzada que han recibido autorización de comercialización en la UE durante en los últimos 10 años (2013-2023).